Orbital yang merosot

- 1930
- 369
- Dallas Bernhard
 Skim tenaga dengan orbital yang diduduki oleh elektron yang hilang. Sumber: Gabriel Bolívar
Skim tenaga dengan orbital yang diduduki oleh elektron yang hilang. Sumber: Gabriel Bolívar The Orbital yang merosot Mereka adalah yang terdapat pada tahap tenaga yang sama. Menurut definisi ini, mereka mesti mempunyai nombor kuantum utama yang sama n. Oleh itu, orbital 2s dan 2p degenerasi, kerana mereka tergolong dalam tahap tenaga 2, walaupun diketahui bahawa fungsi gelombang sudut dan radial mereka berbeza.
Sebagai nilai n, Elektron mula menduduki sub -level tenaga lain, seperti orbital d dan f.
Setiap orbital ini mempunyai ciri -ciri mereka sendiri, yang pada pandangan pertama diperhatikan dalam bentuk sudut mereka; Ini adalah angka sfera, dumbbells (p), daun semanggi (d) dan globular (F).
Antaranya terdapat perbezaan tenaga, bahkan kepunyaan tahap yang sama n.
Sebagai contoh, skim tenaga dengan orbital yang diduduki oleh elektron yang hilang (kes yang tidak normal) ditunjukkan dalam imej atas (kes yang tidak normal).
Ia dapat dilihat dari semua, yang paling stabil (tenaga paling kurang) adalah orbital NS (1s, 2s, ...), manakala NF adalah yang paling tidak stabil (yang mempunyai tenaga terbesar).
Orbital yang merosot dari atom terpencil
Orbital yang merosot, dengan nilai yang sama seperti n, Mereka berada dalam barisan yang sama dalam skim tenaga.
Atas sebab ini, tiga jalur merah yang melambangkan orbital P terletak di garisan yang sama; Seperti dengan cara yang sama jalur ungu dan kuning.
Skim imej melanggar peraturan sink: orbital tenaga yang lebih besar dipenuhi dengan elektron.
Boleh melayani anda: Asid dan Pangkalan: Perbezaan, Ciri, ContohApabila pasangan elektron, orbital kehilangan tenaga, dan menimbulkan penolakan elektrostatik yang lebih besar pada elektron yang hilang dari orbital lain.
Walau bagaimanapun, kesan tersebut tidak dipertimbangkan dalam banyak rajah tenaga. Jika ya, dan mematuhi peraturan sinki tanpa mengisi sepenuhnya orbital d, akan dilihat bahawa mereka berhenti merosot.
Seperti yang dinyatakan di atas, setiap orbital mempunyai ciri -ciri tersendiri. Atom terpencil, dengan konfigurasi elektroniknya, bersedia elektronnya dalam bilangan orbital yang tepat yang membolehkan mereka menjadi tuan rumah mereka.
Hanya mereka yang berada dalam tenaga yang boleh dianggap sebagai degenerasi.
Orbital p
Tiga jalur merah untuk orbital imej imej menunjukkan bahawa kedua -dua px, pdan Dan pz Mereka mempunyai tenaga yang sama.
Terdapat elektron yang hilang dalam setiap satu, yang diterangkan oleh empat nombor kuantum (n, L, ml dan Cik), sementara tiga yang pertama menggambarkan orbital.
Satu -satunya perbezaan di antara mereka dilambangkan oleh momen magnet ml, yang menarik trajektori px Pada paksi x, pdan pada paksi y, dan pz pada paksi z.
Ketiga adalah sama, tetapi mereka hanya berbeza dalam orientasi spatial mereka. Atas sebab ini mereka sentiasa ditarik dalam tenaga, iaitu, merosot.
Seperti yang sama, atom nitrogen inomotif (dengan konfigurasi 1S22s22 p3) Anda mesti menyimpan tiga orbital anda yang merosot. Walau bagaimanapun, senario tenaga berubah tiba -tiba jika dianggap sebagai atom n dalam molekul kimia atau kompaun.
Ia begitu kerana walaupun px, pdan Dan pz Mereka adalah sama dalam tenaga, ini boleh berbeza -beza dalam setiap mereka jika mereka mempunyai persekitaran kimia yang berbeza; iaitu, jika mereka dikaitkan dengan atom yang berbeza.
Boleh melayani anda: isopreno: struktur, sifat, aplikasiOrbital d
Lima jalur ungu menunjukkan orbital d. Dalam atom terpencil, walaupun mereka mempunyai elektron berpasangan, mereka dianggap bahawa lima orbital ini merosot. Walau bagaimanapun, tidak seperti orbital p, kali ini terdapat perbezaan yang ketara dalam bentuk sudut mereka.
Oleh itu, elektron mereka mengarah ke ruang angkasa yang berbeza dari satu orbital d ke yang lain.
Punca ini, menurut Teori medan kristal, bahawa gangguan minimum menyebabkan a Tenaga Terlibat orbital; Iaitu, lima jalur ungu terpisah meninggalkan jurang tenaga di antara mereka:
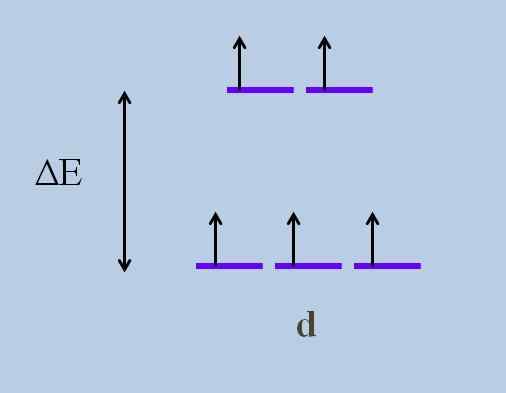 Skim orbital yang terbentang tenaga. Sumber: Gabriel Bolívar
Skim orbital yang terbentang tenaga. Sumber: Gabriel Bolívar Apakah orbital di atas dan yang mana di bawah? Yang di atas dilambangkan sebagai dang, dan orang -orang di bawah t2 g.
Perhatikan bagaimana pada mulanya semua jalur ungu diselaraskan, dan kini satu set dua orbital telah terbentuk dang lebih banyak tenaga daripada tiga orbital lain t2 g.
Teori ini membolehkan untuk menerangkan peralihan D-D, yang mana banyak warna yang diperhatikan dalam sebatian logam peralihan (CR, MN, Iman, dan lain-lain diberikan.).
Gangguan elektronik ini disebabkan oleh interaksi koordinasi pusat logam dengan molekul lain yang dipanggil Ligan.
Orbital f
Dan dengan orbital f, tujuh jalur kuning, keadaan semakin rumit. Alamat spatialnya sangat berbeza di antara mereka, dan visualisasi pautan mereka menjadi terlalu kompleks.
Sebenarnya, dianggap bahawa orbital f adalah lapisan dalaman yang mereka tidak "mengambil bahagian dalam" dalam pembentukan pautan.
Ia boleh melayani anda: Perchloric Oxide (CL2O7)Apabila atom yang diasingkan dengan orbital f dikelilingi oleh atom lain, interaksi bermula dan berlaku berlaku (kehilangan degenerasi):
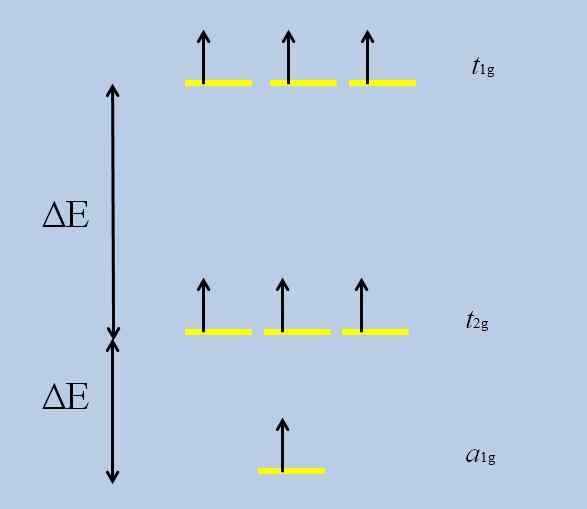 Skim kerugian degenerasi. Sumber: Gabriel Bolívar
Skim kerugian degenerasi. Sumber: Gabriel Bolívar Perhatikan bahawa sekarang jalur kuning membentuk tiga set: t1g, t2 g dan ke1g, Dan mereka tidak lagi merosot.
Orbital hibrid yang merosot
Telah dilihat bahawa orbital boleh berlaku dan kehilangan degenerasi. Walau bagaimanapun, walaupun ini menerangkan peralihan elektronik, ia tidak menjelaskan bagaimana dan mengapa terdapat geometri molekul yang berbeza. Di sini orbital hibrid masuk.
Ciri utamanya ialah mereka merosot. Oleh itu, mereka timbul dari campuran watak orbit s, p, d dan f, untuk menyebabkan hibrida merosot.
Sebagai contoh, tiga orbital p bercampur dengan satu s untuk memberikan empat orbital SP3. Semua orbital SP3 Mereka degenerasi, dan oleh itu mempunyai tenaga yang sama.
Jika tambahan dua orbital bercampur dengan empat SP3, Enam orbital akan diperolehi3d2.
Dan bagaimana geometri molekul menerangkan? Oleh kerana terdapat enam, dengan tenaga yang sama, mereka mestilah dipandu secara simetri di ruang untuk menghasilkan persekitaran kimia yang sama (contohnya, dalam sebatian MF6).
Apabila mereka melakukannya, satu octahedron koordinasi terbentuk, yang sama dengan geometri octahedral di sekitar pusat (m).
Walau bagaimanapun, geometri biasanya menunjukkan gangguan, yang bermaksud bahawa walaupun orbital hibrid tidak sepenuhnya merosot.
Oleh itu, sebagai kesimpulan, orbital yang merosot hanya wujud dalam atom terpencil atau persekitaran yang sangat simetri.
Rujukan
- Definisi Degerate. Pulih dari: chemicool.com
- Atom dan orbital atom. Pulih dari sparknotes.com
- Whitten, Davis, Peck & Stanley. Kimia. (8.ª ed.). Pembelajaran Cengage.

