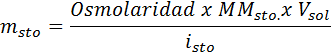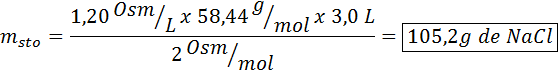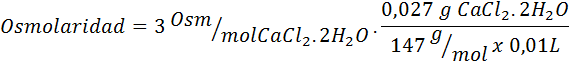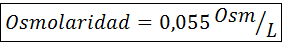Osmolarity
- 3644
- 546
- Miss Elmer Hagenes
Apakah osmolarity?
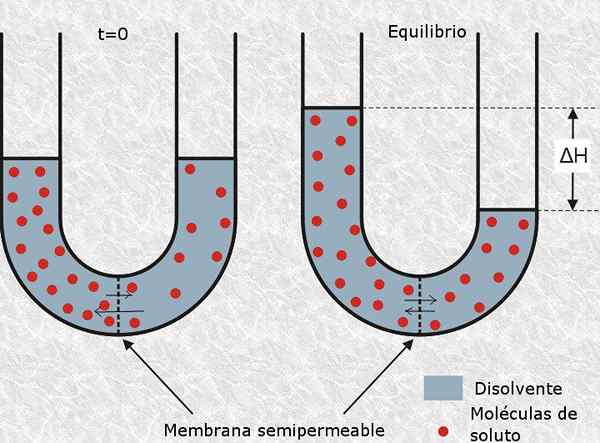
The Osmolarity Ia adalah unit tumpuan yang menunjukkan kepekatan molar set zarah aktif osmotik yang terdapat dalam larutan. Dengan kata lain, osmolariti adalah molariti zarah aktif osmotik.
ditakrifkan sebagai zarah aktif osmotik kepada molekul neutral atau ion yang tidak dapat menyeberang membran semipermeable, seperti membran sel. Kehadiran zarah jenis ini menghasilkan tekanan osmotik dalam larutan, dan oleh itu namanya.
Bilangan tahi lalat zarah aktif osmotik dipanggil Osmoles (diwakili oleh simbol OSM), jadi osmolariti dinyatakan dalam unit OSM/L.
Kepentingan osmolariti
Osmolarity adalah konsep yang sangat penting untuk biologi dan perubatan, kerana keseimbangan sel osmotik dengan persekitaran mereka adalah penting untuk kelangsungan hidup mereka. Sebagai contoh, menyuntik penyelesaian dengan osmolariti yang sangat tinggi atau sangat rendah secara intravena, dengan mudah boleh menyebabkan kematian kepada pesakit.
 Osmolarity adalah aspek penting penyelesaian dalam bidang perubatan dan biologi
Osmolarity adalah aspek penting penyelesaian dalam bidang perubatan dan biologi Sebaliknya, teknik yang sangat biasa yang digunakan oleh ahli biologi sel untuk memecahkan sel dari pelbagai jenis adalah melalui lisis osmotik. Ini terdiri daripada meletakkan sel -sel dalam larutan hipotonik (dengan osmolaritas yang sangat rendah) sehingga air larutan menembusi mereka dengan osmosis dan pecah mereka.
Ini menjadikannya sangat penting, baik untuk doktor dan ahli biologi dan profesional dari kawasan lain, mengetahui, mengukur atau mengetahui cara mengira osmolariti penyelesaian.
Boleh melayani anda: kepekatan peratusanPerbezaan antara osmolariti dan osmolality
Semasa bercakap mengenai osmolariti, juga perlu bercakap mengenai osmolality. Osmolality serupa dengan osmolarity, dengan cara yang sama bahawa moral adalah serupa dengan molariti.
Sementara osmolariti menunjukkan Bilangan osmoles seliter penyelesaian (OSM/L), Osmolality menunjukkan yang sama, tetapi Untuk setiap kilogram pelarut (OSM/kg).
Osmolality mempunyai kelebihan yang, tidak bergantung pada jumlah penyelesaian, dan tidak bergantung pada ketumpatan atau suhu. Atas sebab ini, penyelesaian akan mempunyai osmolality yang sama pada 25 ° C pada 37 ° C. Sebaliknya, osmolariti 37 ° C akan sedikit lebih rendah daripada osmolaritasnya pada 25 ° C, disebabkan peningkatan jumlah pengembangan haba.
Osmolarity biasanya lebih mudah untuk mengukur eksperimen daripada osmolarity. Walau bagaimanapun, osmolariti lebih mudah dikira dan merupakan unit yang lebih mudah untuk berfungsi apabila disediakan.
Bagaimana osmolariti penyelesaian dikira?
Terdapat beberapa cara untuk mengira osmolariti penyelesaian, bergantung kepada maklumat yang dikira. Ia boleh dikira dari:
- Jumlah larutan dan larutan.
- Molariti larutan hadir.
- Kepekatan ion individu.
- Peratusan m/v larut, antara lain.
Dalam semua kes, pengiraan adalah berdasarkan formula umum osmolarity, iaitu:

Di mana nOSM Ia adalah bilangan osmoles yang ada dalam penyelesaian dan Vmatahari Ia adalah jumlah yang sama yang dinyatakan dalam liter. Bilangan osmole dikira dengan mengalikan bilangan tahi lalat dalam larut dengan bilangan zarah di mana ia memisahkan penyelesaian.
Boleh melayani anda: Campuran heterogen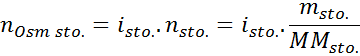
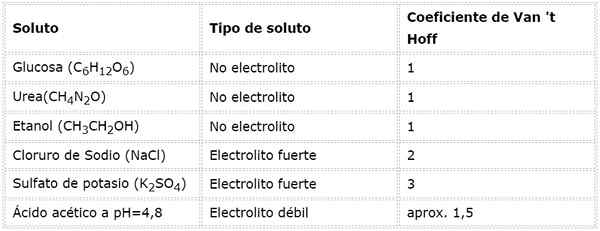
Dalam persamaan ini, nSto Ia adalah bilangan tahi lalat larut, mSto adalah jisimnya (dalam g), MmSto Ia adalah jisim molarnya (dalam g/mol) dan YoSto Ia adalah pekali van 't hoff solute. Pekali ini mempunyai nilai daripada 1 untuk larutan bukan elektrolit (Seperti glukosa, contohnya).
Untuk elektrolit yang kuat yang dipisahkan sepenuhnya (seperti natrium klorida, NaCl) pekali van 't hoff adalah sama dengan jumlah ion di mana setiap tahi lalat sebatian memisahkan.
Contohnya, dalam hal kalium sulfat, k2SW4, tindak balas pemisahannya ialah:
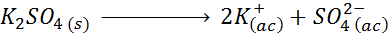
Setiap mol garam yang larut menghasilkan 3 mol ion (2 k ion+ Dan 1 So ion42-), oleh itu I = n = 3.
Sekiranya berlaku elektrolit yang lemah, pengiraan lebih rumit, tetapi biasanya ditentukan secara eksperimen. Jadual berikut meringkaskan koefisien van 't hoff untuk beberapa larutan biasa.
Contoh pengiraan osmolariti
1. Contoh 1
Tentukan osmolariti penyelesaian yang disediakan dengan membubarkan 10 g NaCl dan 10 g glukosa dalam 100 ml larutan
Penyelesaian: Dalam kes ini, osmoles setiap larutan dikira secara berasingan dan kemudian tambah. Jisim molar masing -masing adalah 58.45 g/mol dan 180 g/mol, dan pekali ve 't hoff adalah 2 dan 1:
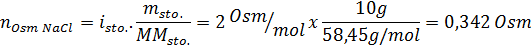
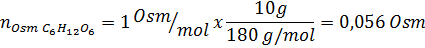
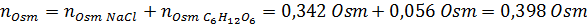
Sekarang kita mengira osmolarity menggunakan formula, mengetahui bahawa 100 ml sama dengan 0.100L:
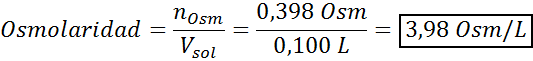
Akhirnya, osmolariti penyelesaiannya ialah 3.98 OSM/L.
2. Contoh 2
Tentukan osmolarity 0.05 larutan kalium sulfat molar.
Penyelesaian: Sekiranya kita sudah mengetahui molariti larut, mengira osmolaritas semudah mengalikan kepekatan ini oleh faktor van 't hoff.
Boleh melayani anda: benzaldehyde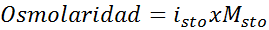
Dalam kes ini, faktor garam adalah 3.
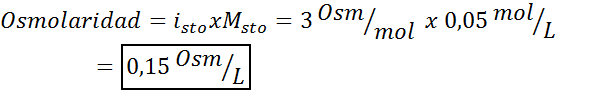
3. Contoh 3
Tentukan osmolariti sampel plasma yang mengandungi ion natrium 0.125 m, ion kalium 0.020 m dan 0.145 ion klorida.
Penyelesaian: Osmolariti ion individu adalah sama dengan molariti mereka, kerana ion tidak memisahkan lebih banyak dan mempunyai i = 1. Atas sebab ini, dalam kes ini hanya perlu membiak oleh I = 1 Setiap kepekatan dan tambah:
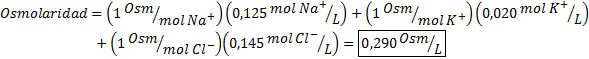
4. Contoh 4
Kirakan osmolariti penyelesaian yang mengandungi 27 mg topi2.2h2Atau untuk setiap 10 ml penyelesaian
Penyelesaian: Berat molekul COCHL2.2h2Atau ia adalah 147 g/mol. Apabila larut, garam ini dipisahkan menjadi 2 molekul air dan tiga ion. Walau bagaimanapun, molekul air bukan zarah aktif osmotik supaya mereka tidak diambil kira untuk pengiraan osmolarity, dan pekali untuk sebatian ini adalah 3.

5. Contoh 5
Apa jisim natrium klorida diperlukan untuk menyediakan 3 liter penyelesaian yang osmolaritasnya ialah 1.20 OSM/L?
Penyelesaian: Dalam kes ini, kerana jisim larut diminta dan kami mempunyai jumlah dan kepekatan, sudah cukup untuk membersihkan jisim formula osmolarity.