Struktur, sifat hidrogen peroksida, sifat, kegunaan, mendapatkan

- 4710
- 211
- Erick Krajcik
Dia hidrogen peroksida Ia adalah sebatian bukan organik yang formula kimia adalah h2Sama ada2. Semua orang adalah peroksida yang paling mudah dari keluarga ini sebatian kimia. Formula strukturnya adalah H-O-O-H, jambatan oksigen dalaman ini menjadi ciri untuk semua peroksida.
Pada tahun 1818, h2Sama ada2 Ia dikenal pasti oleh Louies Jacques Thénard, yang menyediakan sebatian kimia yang dipanggilnya kemudian Huzigenada. Ia adalah sebatian yang tidak stabil, terurai dengan pendedahan kepada cahaya, haba dan beberapa logam.
 Formula kimia hidrogen peroksida
Formula kimia hidrogen peroksida Ia adalah sebatian yang sangat berguna yang digunakan dalam pembasmian kuman luka kecil, pemutihan rambut, rawatan air, dll. Walaupun dia boleh mempunyai tindakan yang berbahaya bagi manusia, didapati di semua sel eukariotik makhluk hidup, di mana dia melakukan beberapa fungsi yang bermanfaat.
Hidrogen peroksida menghasilkan pengoksidaan bahan toksik seperti fenol, etanol, formaldehid, dll., produk yang dihapuskan oleh hati dan buah pinggang. Di samping itu, ia menyumbang kepada pemusnahan bakteria yang phagocyted oleh leukosit neutrofil dan makrofag.
[TOC]
Struktur
Molekul
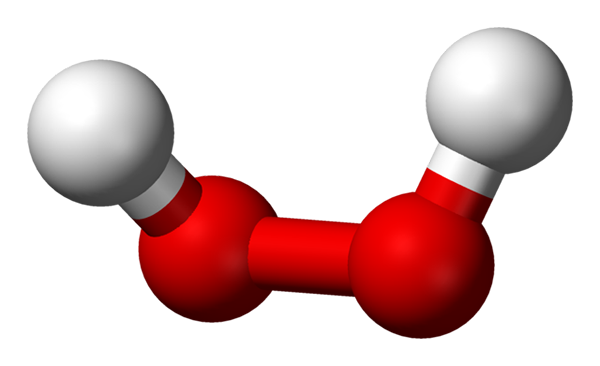 Molekul hidrogen peroksida yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 melalui Wikipedia.
Molekul hidrogen peroksida yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 melalui Wikipedia. Dalam imej unggul struktur molekul h dapat dilihat2Sama ada2 (H-O-O-H), dengan sfera merah sepadan dengan atom oksigen, dan atom hidrogen putih. Perhatikan bahawa molekul tidak rata, dan bahawa atom h tidak dilekatkan di ruang angkasa (satu di hadapan yang lain).
Menariknya, ke H2Sama ada2 Adalah sukar untuk memutar pautan pusat mudah O-O, jadi kedudukan H ini tidak dapat ditukar; seseorang tidak akan turun sementara yang lain naik.
Kerana? Kerana dalam dua atom oksigen terdapat dua pasangan bebas elektron, yang memberikan lapan elektron yang sangat dekat dan yang menangkis satu sama lain untuk caj negatif mereka.
Putaran
Walaupun begitu, pautan O-O mungkin berputar kerana interaksi dengan persekitarannya.
Sebagai contoh, apabila bersama -sama dengan dua ibu jari, dengan jari -jari dilanjutkan dan yang lain ditutup, seperti melukis mahkamah, dan kemudian menjadikan ibu jari sedemikian rupa sehingga salah satu jari menargetkan ke hadapan dan yang lain ke belakang, akan ada anggaran perwakilan H2Sama ada2.
Jika badan memainkan mana -mana indeks, ibu jari akan berputar sebagai tindak balas kepada interaksi ini; Walau bagaimanapun, mereka akan segera kembali ke kedudukan asal mereka kerana penolakan elektronik yang disebutkan di atas. Putaran ini membingkai aspek dinamik molekul ini.
Interaksi intermolecular
Dalam keadaan cecair, h2Sama ada2 berjaya menubuhkan jambatan hidrogen (Hooh-O2H2), jika tidak, titik mendidih yang tinggi (150 ºC) tidak akan dijelaskan berbanding dengan air.
Boleh melayani anda: kalsium sulfat (case4): struktur kimia, sifat, kegunaanSebaik sahaja ia berlalu ke fasa gas, molekul m2Sama ada2 Mungkin tidak lagi dapat membentuk jambatan sedemikian, bukan hanya dengan jarak intermolecular yang paling besar, tetapi juga atom hidrogen akan menjadi yang pertama disentuh sekiranya berlaku perlanggaran (ini dapat divisualisasikan dengan kembali ke model jari).
Sementara itu, dalam fasa pepejal sudut pesawat yang menubuhkan H ialah 90º (meletakkan jari tegak)). Sekarang jambatan hidrogen menjadi lebih penting dan molekul h2Sama ada2 Mereka diperintahkan dalam kristal struktur tetragonal.
Sifat
Sbotella dengan hidrogen peroksida. Di farmasi ia dicapai dengan kepekatan 3% m/v. Sumber: Pixnio.
Nama
-Hidrogen peroksida
-Dioxidano
-Oxidanol
-Asid permydoxic
-O-Hydroxyol
-Hidrogen peroksida
Jisim molar
34,0147 g/mol
Penampilan fizikal
Biru pucat (pekat) atau tidak berwarna. Ia sedikit lebih likat dan padat daripada air. Ia disuling untuk keselamatan pada suhu rendah dan tekanan yang dikurangkan, kerana ia terurai dengan pemanasan meletup.
Bau
Akut atau bau yang serupa dengan ozon.
Rasa
Pahit
Ketumpatan
Pepejal 1.71 g/cm3
Ketumpatan penyelesaian berair mereka bergantung kepada kepekatan mereka; Sebagai contoh, 27 % mempunyai ketumpatan 1.10 g/cm3, manakala 50 %, 1.13 g/cm3
Takat lebur
- 0.43 ºC
Takat didih
150.2 ºC. Nilai ini diperolehi dengan ekstrapolasi, kerana hidrogen peroksida terurai pada suhu tinggi.
Kelarutan air
Stacble ≥ 100 mg/ml pada 25 ° C
Kelarutan
Ia larut dalam eter dan alkohol, tetapi tidak larut dalam minyak eter. Ia terurai dalam air dan oksigen dalam banyak pelarut organik.
Pekali partisi oktanol/air
Log p = - 0.43
Tekanan wap
5 mmHg pada 30 ºC.
Pemisahan pemalar
PKA = 11.72
Ph
Penyelesaian hidrogen peroksida sedikit berasid. Sebagai contoh, satu hingga 35% mempunyai pH 4.6; Tetapi apabila menumpukan pada 90%, pH menjadi kurang berasid: 5.1.
Indeks pembiasan (nD)
1,4061
Goo
1,245 cpoise pada 20 ° C.
Kapasiti haba
1,267 j/g · k (gas)
2,619 j/g · k (cecair)
Haba pengewapan
1,519 j/g · k
Kestabilan
Stabil di bawah syarat yang disyorkan. Penambahan garam acetanylide dan timah menstabilkannya.
Kakisan
Menghakis
Penguraian
Ia terurai dengan pendedahan kepada cahaya atau dengan kehadiran bahan pengoksidaan dan pengurangan. Ia juga dipecah oleh pemanasan. Apabila ia dirampas, air dan oksigen dilepaskan, dan disukai oleh peningkatan pH dan suhu, serta dengan kehadiran enzim catlase.
Boleh melayani anda: Natrium peroksida (Na2O2): Struktur, sifat, kegunaanKetegangan permukaan
80.4 Dins/cm A 20 ºC
Reaktiviti
H2Sama ada2 Ia bertindak sebagai ejen pengoksidaan dalam penyelesaian asid besi ferus (iman2+) Besi ferrik (f3+); juga mengoksidakan ion sulfit (begitu32-) ke ion sulfat (begitu42-).
Ia juga boleh bertindak sebagai ejen pengurangan dengan kehadiran penyelesaian asas, mengurangkan kepada natrium hipoklorit (NAOCL) dan kalium permanganat (KMNO4) Dengan pelepasan oksigen.
Aplikasi
Pemutihan
Hidrogen peroksida digunakan dalam industri kertas dalam pemutihan pulpa dan kertas, yang menggunakan sebahagian besar pengeluaran tahunannya.
Disinfectant
Hidrogen peroksida adalah antiseptik lembut untuk mengelakkan jangkitan luka kecil, luka dan luka bakar. Ia juga digunakan sebagai bilas mulut dan melegakan kerengsaan mulut ringan kerana kehadiran mulut atau gingivitis.
Ia juga digunakan untuk membasmi permukaan, bahagian dalam peti sejuk, air dan memerangi pertumbuhan bakteria yang berlebihan dalam sistem air dan menara penyejuk. Hidrogen peroksida melepaskan radikal bebas oksigen, yang menguraikan bahan pencemar.
Bahan pencuci
Hidrogen peroksida digunakan dalam pembuatan pencuci pakaian pemutihan, termasuk natrium karbonat. Sebatian ini adalah kompleks natrium karbonat dan hidrogen peroksida yang dibubarkan di dalam air memisahkan dalam komponennya.
Aplikasi Kosmetik
Cair hidrogen peroksida digunakan dalam pemutihan rambut, sebelum pewarnaan. Ia juga digunakan untuk melunturkan gigi, sebagai sebahagian daripada krim gigi buatan sendiri.
Propelan
Hidrogen peroksida digunakan sebagai komponen monoporpellant atau pengoksidaan roket bipropoon. Ia merosakkan melepaskan oksigen dan air, ciri yang membolehkan penggunaannya sebagai propelan.
Sel tindak balas dipam dengan kehadiran pemangkin yang mempercepat penguraian tersebut. Semasa ini, wap air dihasilkan pada suhu tinggi.
Apabila stim diusir melalui jurang menghasilkan dorongan. Kapal selam V-80 yang dibina pada tahun 1940, yang digunakan dalam turbin oksigen yang dihasilkan daripada hidrogen peroksida; Sistem Turbin Walter yang dipanggil.
Memperoleh
Pada mulanya hidrogen peroksida diperolehi secara industri oleh hidrolisis ammonium persulfat, [(NH4)2S2Sama ada8] atau elektrolisis ammonium bisulfat, NH4Hso4.
Hidrogen peroksida diperolehi secara industri melalui penggunaan antraquinone. Proses ini dijalankan dalam empat peringkat: penghidrogenan, penapisan, pengoksidaan, pengekstrakan dan pembersihan.
Boleh melayani anda: magnesium fluorida: struktur, sifat, sintesis, kegunaanHidrogenasi
Alquilanttroquinona dihidrogenasi dengan melewati gas hidrogen melalui hidrogenator yang dimuatkan dengan alumina dan sedikit pemangkin (paladium). Suhu dikekalkan pada 45 ºC dengan pengadukan tetap.
Alkyndroquinone diubah menjadi alquiloantrahydroquinona dan tetrahydroalquilantrahydroquinone, memilih yang terakhir untuk kemudahannya yang paling besar untuk prosedur berikut.
Penapisan
Penyelesaian yang terkandung.
Pengoksidaan
Penyelesaian yang ditapis mengoksidakan dengan melepasi udara melaluinya, membentuk hidrogen peroksida yang rendah.
Pengekstrakan dan Pembersihan
Penyelesaian dengan hidrogen peroksida melintasi lajur pengekstrakan cecair cecair. Air mengalir melalui lajur, sementara larutan dengan hidrogen peroksida dipam olehnya.
Air mencapai bahagian bawah pengekstrak dengan kepekatan hidrogen peroksida antara 25 dan 35 % P/P. Kemudian, ia disucikan oleh penyulingan vakum, hingga kepekatan hidrogen peroksida 30 %. Akhirnya stabil dan disimpan.
Risiko
 Hidrogen peroksida terbakar. Sumber: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Hidrogen peroksida terbakar. Sumber: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Hidrogen peroksida adalah ejen yang menghakis, jadi sentuhan kulit menghasilkan kerengsaan yang teruk, sebagai tambahan kepada pemutihan sementara (imej unggul). Ia juga boleh menghasilkan kerosakan mata, gatal -gatal, salt, kemerahan dan pembentukan ampul.
Penyedutannya menghasilkan kerengsaan di hidung, tekak dan paru -paru. Sementara itu, pendedahan berulang boleh menyebabkan bronkitis, batuk, kahak dan pernafasan pemendekan. Dan seolah -olah ia tidak mencukupi, ia juga menghasilkan sakit kepala, vahid, loya dan muntah.
Pendedahan serius terhadap hidrogen peroksida dapat menghasilkan pengumpulan cecair di paru -paru, yang dikenali sebagai edema pulmonari: keadaan serius yang memerlukan perhatian perubatan segera.
Pentadbiran Keselamatan dan Kesihatan Pekerjaan (OSHA) telah menubuhkan maksimum yang dibenarkan untuk hidrogen peroksida 1 ppm dalam persekitaran kerja pada hari 8 -jam. Walau bagaimanapun, kerana ia adalah sebatian mutagenik, pendedahan kepada minimum mesti dikurangkan.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Hidrogen peroksida. Diperoleh dari: dalam.Wikipedia.org
- William r. Berpusing dan Henri a. Levi. (2004). Struktur kristal dan molekul hidrogen peroksida: kajian neutron - difraksi. doi.org/10.1063/1.1696379
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Hidrogen peroksida. Pangkalan data PUBCHEM. CID = 784. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Editor enyclopaedia Britannica. (27 November 2018). Hidrogen peroksida. Encyclopædia Britannica. Pulih dari: Britannica.com
- Jabatan Kesihatan New Jersey. (2016). Hidrogen peroksida. [Pdf]. Pulih dari: NJ.Gov
- Mathews, c. K., Van holde, k. Dan., Ahern, k. G. (2002). Biokimia. Edisi ketiga. Editorial Pearson Addison Wesley
- MD Web. (2019). Hidrogen peroksida. Diperolehi dari: WebMD.com
- « Sejarah Perubatan Aztec, Tuhan, Tumbuhan, Penyakit
- Struktur Zink Oxide (ZnO), sifat, kegunaan, risiko »

