Fundamental Potentiometri, Persamaan, Elektrod

- 724
- 39
- Ms. Micheal Rippin
The Potentiometri Ini adalah teknik analisis elektrokimia yang berdasarkan pengukuran voltan, medium atau petak, yang mana aktiviti atau kepekatan spesies (ionik atau molekul) ditentukan. Ini adalah teknik yang tidak merosakkan, kerana ia tidak berusaha mengubah suai sifat kimia analit yang dipersoalkan.
Untuk menjalankan analisis ini, sekurang -kurangnya dua elektrod sangat diperlukan: salah satu rujukan dan penunjuk atau kerja lain. Begitu juga, mesti ada voltmeter impedans yang tinggi, yang mana voltan diukur tanpa membenarkan aliran elektron yang cukup antara kedua -dua elektrod dan penyelesaian yang mengelilingi mereka.
 Perwakilan umum unsur -unsur yang diperlukan untuk analisis potentiometrik. Sumber: Gabriel Bolívar.
Perwakilan umum unsur -unsur yang diperlukan untuk analisis potentiometrik. Sumber: Gabriel Bolívar. Di atas kita mempunyai perwakilan umum perhimpunan untuk analisis potentiometrik. Di dalam petak di mana elektrod penunjuk diperkenalkan adalah spesies yang kepekatannya yang ingin kita tentukan; Semasa dalam elektrod rujukan kita mempunyai penyelesaian lain, di mana kita mengetahui kepekatan komponennya.
Pembacaan voltan berdaftar adalah, pada dasarnya, kepada spesies kepentingan yang menghampiri elektrod penunjuk. Dengan voltan ini kita mengira kepekatan spesies ini, contohnya, ia2+, Ag+, H+, Na+, K+, Cl-, dan lain-lain. Oleh itu, potentiometri telah menggunakannya dalam kimia klinikal, alam sekitar, analisis dan fizikokimia.
[TOC]
Asas
Voltan yang ditentukan dalam analisis potentiometrik ialah sel, dansel, yang merupakan perbezaan antara voltan yang disebabkan oleh dua elektrod, penunjuk dan rujukan. Elektrod sensitif terhadap aktiviti molekul atau ion yang mengelilinginya, dapat menerima elektron mereka, atau sebaliknya menghasilkan mereka.
Kedua -dua petak ini disambungkan, jadi elektrod elektrod mengalir di mana pengurangan berlaku (katod), ke elektrod di mana pengoksidaan (anod) berlaku (anod).
Walau bagaimanapun, pemindahan elektron (atau arus) ini hampir tidak ada, kerana sebaliknya tindak balas redoks akan berubah sepenuhnya mengubah suai kepekatan dan identiti spesies yang terlibat.
Boleh melayani anda: hydrogen bromide (hbr)Sebaliknya, voltmeter hampir tidak membolehkan laluan elektron, sehingga terdapat bacaan voltan yang stabil, dan sel dapat mencapai keseimbangan termodinamik.
Oleh itu, dikatakan bahawa potentiometri adalah teknik yang tidak merosakkan, kerana beberapa ion atau molekul berubah menjadi proses pengukuran, yang juga boleh diterbalikkan.
Persamaan utama
Potensi sel
Potensi sel berkaitan dengan aktiviti atau kepekatan spesies kepentingan melalui persamaan Nernst:
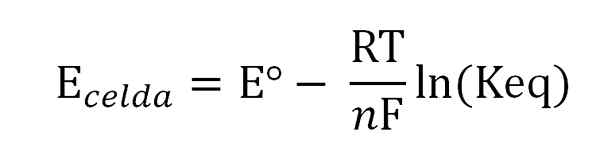 Persamaan Nernst. Sumber: Gabriel Bolívar.
Persamaan Nernst. Sumber: Gabriel Bolívar. Di mana eº adalah potensi sel yang sama dalam keadaan standard, f pemalar faraday, n Bilangan elektron yang dipindahkan, r pemalar gas, dan keq adalah keseimbangan keseimbangan reaksi global. Pengiraan dibuat dengan membersihkan keq dari bacaan esel, dan mengira kepekatan keseimbangan yang dikehendaki.
Walau bagaimanapun, mudah untuk mengira kepekatan dengan laluan yang lebih mudah. Dengan konvensyen, potensi sel juga diberikan oleh persamaan berikut:
Dansel = Egrid- Danlembu
Di mana egrid Ia adalah potensi untuk pengurangan semi -media, di mana elektrod penunjuk terletak; sementara elembu Ia adalah potensi untuk pengoksidaan semi -media, di mana kita mempunyai elektrod rujukan. Oleh itu, persamaan boleh ditulis semula sebagai:
Dansel = Epenunjuk - Danrujukan + DanJ
Menjadi eJ sama dengan potensi yang disebabkan oleh sendi jambatan bersama. Dalam amalan, danJ Ia tidak dapat ditentukan, tetapi memastikan nilainya adalah minimum yang mungkin menggunakan penyelesaian yang sangat dicairkan, atau memastikan bahawa komposisi di kedua -dua petak adalah serupa.
Potensi Analit
Dari persamaan sebelumnya kita dapat mengira danpenunjuk, yang menjadi potensi yang benar -benar menarik minat kita. Dengan nilai itu, kami menggunakan persamaan Nernst sekali lagi:
Boleh melayani anda: Acetonitrile (C2H3N)Danpenunjuk = Eº - (rt/nf) ln (merah/lembu)
Rangkaian adalah bentuk yang dikurangkan dari analit atau spesies yang menarik, dan OX adalah bentuk teroksida. Dengan mengandaikan bahawa analit adalah Zn kation2+ Pada elektrod zink logam, kita akan mempunyai:
Danpenunjuk = EºZn2+/Zn - (Rt/nf) ln (1/keZn2+)
Di mana keZn2+ Ia adalah aktiviti kation Zn2+, yang dengan pelarasan eksperimen agak dekat dengan kepekatannya, [Zn2+]. Dari persamaan ini kepekatan Zn dibersihkan2+, yang dapat dilihat, secara langsung mempengaruhi nilai epenunjuk.
Bentuk zink yang dikurangkan, Zn, membentangkan aktiviti yang sama dengan 1. Oleh itu, persamaan umum untuk kation berkarat logam yang bertindak sebagai elektrod akan sama dengan:
Danpenunjuk = EºMn+/m - (Rt/nf) ln (1/keM+n)
Tetapi ini hanya terpakai dalam kes elektrod spesies pertama.
Elektrod
Elektrod, sebagai tambahan kepada voltmeter, adalah elemen yang paling penting dari sebarang analisis potentiometrik. Sebilangan daripada mereka akan disebutkan di bawah.
Spesies pertama
Elektrod spesies pertama adalah logam yang mengoksidakan untuk menyebabkan kation, menjalankan elektron ke voltmeter. Sebahagian daripada ini adalah seperti berikut: Ag, Zn, Cu, Hg, Sn, TL, Cd dan Bi.
Tidak semua logam berfungsi sebagai elektrod kelas pertama, kerana mereka tidak boleh membentangkan penyelewengan kristal atau permukaan yang diliputi oleh lapisan oksida yang menyebabkan voltan yang tidak stabil.
Spesies kedua
Elektrod spesies kedua, sebaliknya, juga logam, tetapi juga mengandungi garam di permukaannya, yang kelarutannya bergantung pada reaksi redoks yang berlaku. Sebagai contoh, elektrod Ag-AGCl dan Hg-Hg2Cl2 (Calomel), adalah elektrod spesies kedua.
Ion terpilih
Elektrod ion selektif, juga dikenali sebagai membran, adalah yang sensitif terhadap ion atau molekul tertentu, yang menyelinap melalui membran yang direka hanya untuk dia lulus dan bukan spesies lain dalam penyelesaian.
Boleh melayani anda: Mengehadkan dan reagen yang berlebihanContoh kegemaran elektrod jenis ini ialah kaca, dibina untuk menentukan kepekatan ion H3Sama ada+ atau h+, Dan dengan itu berfungsi sebagai pehometer.
Aplikasi potentiometri
Kimia Enviromental
Potentiometri telah digunakan dalam kimia alam sekitar dalam penentuan ion cn-, F- dan tidak3-, serta ammonia dalam arus air.
Kimia Klinikal
Elektrod selektif sangat berguna apabila media pengukuran adalah kompleks. Oleh itu, ion atau molekul lain akan mengganggu pembacaan.
Ciri ini amat bermanfaat dalam penentuan potentiometrik yang dijalankan dalam sel yang sama, di mana mikroelekrod disuntik untuk menentukan kepekatan k k+, Na+, Cl-, Ac2+ atau h+.
Darjah potentiometrik
Katakan bahawa di tengah -tengah di mana kita mempunyai elektrod penunjuk Tajuk ditambah yang bertindak balas dengan analit dan, oleh itu, ia mengubah kepekatannya. Kemudian perubahan akan berlaku di esel, yang akan sesuai dengan cara yang sama dengan perubahan pH dalam titrasi asid-asas.
Oleh itu, grafik dansel Vs. VTitulant, Kita dapat menentukan titik perubahan atau kesetaraan, dan dengan itu kita akan mengetahui kepekatan analit.
Darjah potentiometrik digunakan secara meluas dalam makmal kimia analitik dan fizikokimia. Beberapa analisis yang dapat ditentukan dengan teknik ini adalah seperti berikut: Iman2+, HCO3-, Ac2+, Mg2+, Cu2+, asid askorbik, haluros, antara lain.
Semua darjah, sedikit sebanyak, boleh diikuti melalui potentiometric dan bukannya menggunakan petunjuk dan titik akhir mereka.
Rujukan
- Hari, r., & Underwood, a. (1986). Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall.
- Skoog d.Ke., Barat d.M. (1986). Analisis instrumental. (Kedua ed.). Inter -American., Mexico.
- Dr. Doug Stewart. (2020). Definisi potentiometri. Pulih dari: chemicool.com
- Harvey David. (5 Jun, 2019). Kaedah potntiometric. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Britannica Encyclopaedia. (2020). Electrogravimetry. Pulih dari: Britannica.com
- Wikipedia. (2020). Kaedah Elektroanalytical. Diperoleh dari: dalam.Wikipedia.org

