Operasi Elektrod Calomel, Ciri, Kegunaan

- 2754
- 466
- Anthony Breitenberg
Dia Elektrod Calomel o Calomelanes adalah elektrod sekunder yang membolehkan untuk menentukan potensi separuh hayat, terima kasih kepada reaksi yang berlaku antara merkuri dan merkuri klorida (I), HG2Cl2, dahulunya dikenali sebagai Calomel. Kedua -dua reagen, HG dan HG2Cl2, Mereka menang atau kehilangan elektron bergantung pada medium di mana elektrod direndam.
Biasanya disingkat sebagai EC, elektrod ini menggantikan banyak pengukuran kepada elektrod hidrogen standard (SHE), kerana lebih mudah dibina, dan kurang berisiko untuk memanipulasi (walaupun mempunyai merkuri). Di dalamnya mengandungi penyelesaian KCl sebagai medium elektrolitik untuk aliran elektron.
 Elektrod calomel dalam pengukuran penuh. Sumber: Chandrajit Karmakar, CC By-SA 4.0, melalui Wikimedia Commons
Elektrod calomel dalam pengukuran penuh. Sumber: Chandrajit Karmakar, CC By-SA 4.0, melalui Wikimedia Commons Elektrod Calomel boleh mempunyai varian yang berbeza bergantung pada saiznya, atau lebih penting, kepekatan KCl. Apabila penyelesaian KCl tepu, kita bercakap tentang elektro dari Saturado Calomel (ESC). ESC lebih mudah disediakan daripada EC, tetapi lebih sensitif terhadap perubahan suhu.
Penggunaan elektrod ini telah dibenarkan untuk menentukan potensi separuh hayat untuk reaksi redoks yang tak terhitung jumlahnya. Ia juga merupakan peranti berulang dalam penentuan potentiometrik, yang berusaha mengetahui jumlah analit bergantung kepada sel dan berpotensi diukur.
[TOC]
Berfungsi
Jadi elektrod Calomel berfungsi, pasangan hg-hg2Cl2 Anda mesti bertindak balas, sama ada menang atau kehilangan elektron.
Katodik
Apabila pengurangan atau keuntungan elektron berlaku di dalam elektrod calomel, kita mempunyai reaksi berikut:
Hg2Cl2 → Hg22+ + 2Cl- (Pengionan)
Hg22+ + 2e- → 2Hg (pengurangan)
Hg2Cl2 + 2e- → 2Hg +2Cl- (Reaksi Bersih)
Boleh melayani anda: reaksi eksotermikOleh itu, HG2Cl2 Menang elektron mengurangkan merkuri logam.
Potensi e elektrod apabila pengurangan berlaku diberikan oleh persamaan:
E = eº - 0.0591 log [CL-]
Di mana diperhatikan bahawa ia bergantung secara eksklusif pada kepekatan ion cl-, Menjadi potensi pengurangan standard untuk elektrod yang diukur ini di hadapan elektrod hidrogen standard.
Anodik
Di dalam elektrod proses pengoksidaan juga boleh berlaku:
2Hg → Hg22+ + 2e- (Pengoksidaan)
Hg22+ + 2Cl- → Hg2Cl2 (Hujan)
2HG +2Cl- → Hg2Cl2 + 2e- (Reaksi Bersih)
Iaitu, merkuri mengoksidakan untuk menjana lebih banyak hg2Cl2.
Potensi E dalam kes ini diberikan oleh:
E = eº + 0.0591 log [CL-]
Dan sekali lagi, dan ia bergantung pada [cl-].
Tindak balas umum
Reaksi umum untuk elektrod Calomel adalah:
Hg2Cl2(s) + 2e- ⇌ 2Hg (l) + 2cl-
Rasa keseimbangan akan bergantung pada medium di mana elektrod disentuh. Cl- Tentukan kelarutan HG2Cl2, yang seterusnya memberi kesan kepada pembentukan atau pengoksidaan HG.
Dan potensi yang ditentukan untuk kepekatan ion yang ditentukan- Ia akan sama dengan:
DanCalomel = Egrid - Danlembu
Menjadi eCalomel Potensi yang dilaporkan sebagai rujukan dalam jadual berpotensi tertentu.
Ciri -ciri elektrod calomel
Perwakilan separuh
Calomel Electrode Semi -Edge boleh diwakili seperti berikut:
PT | HG | Hg2Cl2| Cl- (Xm)
Di mana hanya kepekatan ion CL yang penting-, dinyatakan dalam molariti atau normal. Potensi e elektrod akan berbeza -beza jika ia dipenuhi dengan penyelesaian kepekatan KCl yang berbeza.
Contohnya, EC dengan KCL 0.1 m mempunyai dan sama dengan 0.3356 V pada 25 ° C; Manakala ESC, dengan KCl tepu, mempunyai satu dan sama dengan 0.2444 V pada suhu yang sama.
Boleh melayani anda: isopentano: struktur, sifat, kegunaan, memperolehOleh itu, kepekatan KCl adalah ciri yang paling penting dalam elektrod calomel, kerana ia akan menunjukkan apa yang akan digunakan apabila pengiraan pengukuran potentiometrik dilakukan.
Secara komersil, tiga jenis elektrod kalomel dicapai: tepu (ESC), kesembilan belas (0.1 N atau 0.1 M KCl) dan normal (1 N atau 1 M KCl). Elektrod Calomel 1 M KCl akan diwakili sebagai:
PT | HG | Hg2Cl2| Cl- (1 m)
Pihak
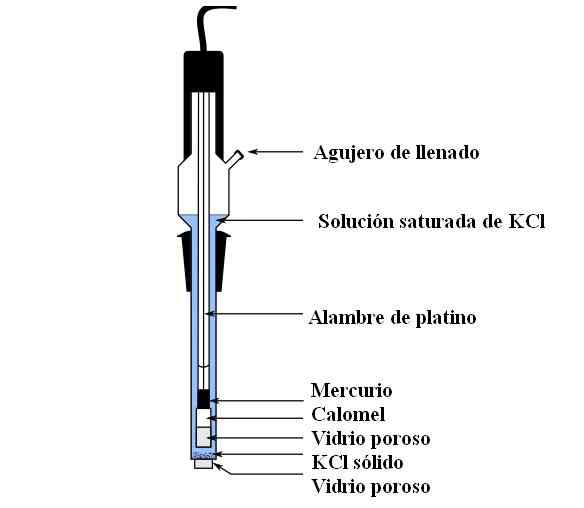 Bahagian elektrod calomel. Sumber: Bachi-Bouzou, CC0, melalui Wikimedia Commons
Bahagian elektrod calomel. Sumber: Bachi-Bouzou, CC0, melalui Wikimedia Commons Di bahagian atas, kami menunjukkan bahagian utama elektrod Calomel biasa. Ia diperbuat daripada kaca, dan terdiri daripada dua bekas: satu luaran, yang dimasukkan ke dalam hubungan elektrokimia dengan medium pengukuran dan mengandungi penyelesaian KCL; Dan yang dalam, di mana campuran HG-hg terletak2Cl2.
Secara dalaman, elektrod calomel mengandungi merkuri cecair, di mana pes hg dipatuhi2Cl2 dibasahkan dengan merkuri. Ini adalah fasa elektrod yang paling aktif. Kaca berliang digunakan untuk membenarkan hanya kemasukan atau keluar dari ion cl-, Tetapi bukan kristal Hg2Cl2 atau Mercury jatuh.
Kabel platinum, di mana aliran elektron, tenggelam dalam merkuri, dan bertanggungjawab untuk menyambungkan elektrod dengan voltmeter dan litar luaran yang dipersoalkan.
Melalui lubang pengisian, larutan KCl dicurahkan, yang mengandungi garam yang dibubarkan. Sementara itu, di bahagian bawah elektrod kita mempunyai pembukaan yang sangat kecil di kaca berliang, yang bersentuhan langsung dengan medium pengukuran. Tujuan kaca berliang adalah untuk membolehkan hubungan tanpa pertukaran bahan yang tidak diingini yang mencemarkan elektrod atau sampel.
Ia boleh melayani anda: Cyclohexen: struktur, sifat, sintesis dan kegunaanKelebihan
Elektrod Calomel membentangkan kelebihan berikut berkenaan dengan elektrod hidrogen standard:
-Senang dibina dan dimanipulasi
-Potensi selnya tetap malar walaupun air menguap
-Anda tidak memerlukan jambatan garam
ESC adalah yang paling mudah untuk dibina dari elektrod Calomel, kerana KCL sudah cukup untuk dibubarkan sehingga kristal mereka terbentuk. Maka penyelesaiannya akan tepu, dan bersedia untuk ditumpahkan di dalam elektrod.
Kekurangan
Walau bagaimanapun, elektrod Calomel membentangkan kelemahan berikut:
-Dengan mengandungi merkuri cecair, ia dapat memberi kesan negatif terhadap alam sekitar
-Ia tidak boleh digunakan untuk analisis kuantitatif dalam sampel dengan suhu lebih besar daripada 60 ºC, kerana HG2Cl2 mula pecah, menyebabkan pembacaan elektrod gagal
ESC juga mempunyai kelemahan yang sangat sensitif terhadap perubahan suhu.
Elektrod perak perak telah menggantikan kalomel dalam banyak penentuan potentiometrik.
Aplikasi
Elektrod Calomel adalah salah satu daripada banyak elektrod yang digunakan setiap hari dalam penentuan potentiometrik, yang membolehkan untuk mendapatkan potensi separuh hayat analisis atau spesies yang menarik.
Juga, elektrod calomel digunakan dalam pengukuran pH dan voltmetri kitaran.
Rujukan
- Hari, r., & Underwood, a. (1986). Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Elektrod calomel tepu. Diperoleh dari: dalam.Wikipedia.org
- Generalic, Eni. (20 Oktober 2018). Elektrod Calomel. Kamus Kimia-Bahasa Croatia & Glosari. KTF-split. 30 Oktober. 2020. Pulih dari: glosari.Periodni.com
- Skoog d.Ke., Barat d.M. (1986). Analisis instrumental. (Kedua ed.). Inter -American., Mexico.
- Hills, g., Ives, d. T. (1950). Elektrod Calomel. Alam 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 Disember 2012). Potentiometri (ii): Elektrod. Diperolehi dari: Triplenlace.com
- « Ciri -ciri paradigma sosio -kritikal, kaedah, wakil
- Fundamental Potentiometri, Persamaan, Elektrod »

