Ciri -ciri Proses Politik, Aplikasi dan Contoh

- 4399
- 709
- Erick Krajcik
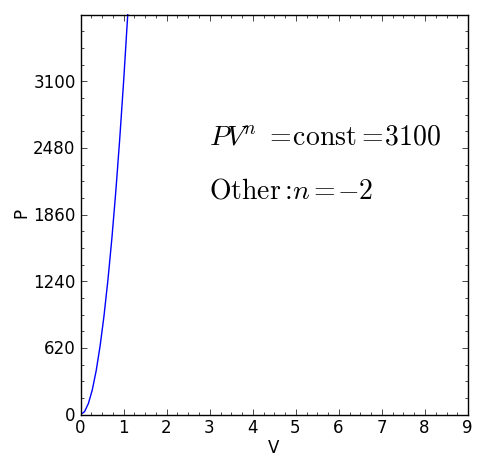
A Proses Politropik Ia adalah proses termodinamik yang berlaku apabila hubungan antara tekanan P dan jumlahnya V diberikan oleh P.Vn Ia tetap malar. Eksponen n Ia adalah bilangan sebenar, umumnya antara sifar dan tak terhingga, tetapi dalam beberapa kes boleh menjadi negatif.
Nilai n terima nama Indeks Politropi Dan penting untuk menyerlahkan bahawa semasa proses termodinamik polytropic mengatakan indeks mesti mengekalkan nilai tetap, jika tidak, proses itu tidak akan dianggap polytropic.
 Rajah 1. Persamaan ciri proses termodinamik polytropic. Sumber: f. Zapata.
Rajah 1. Persamaan ciri proses termodinamik polytropic. Sumber: f. Zapata. [TOC]
Ciri -ciri proses polytropic
Beberapa kes ciri -ciri proses polytropic adalah:
- Proses isoterma (pada suhu T tetap), di mana eksponen adalah n = 1.
- Proses isobaric (tekanan malar p), dalam kes ini n = 0.
- Proses isokorik (kepada volum v tetap), yang mana n =+∞.
- Proses adiabatik (ke entropi berterusan), di mana eksponen adalah n = γ, iaitu γ yang berterusan adiabatik. Pemalar ini adalah kuota antara kapasiti haba pada tekanan tetap CP dibahagikan dengan kapasiti haba pada jumlah CV yang tetap:
γ = cp/cv
- Mana -mana proses termodinamik lain yang bukan mana -mana kes sebelumnya. Tetapi mematuhi P.Vn = ctte Dengan indeks polytropic sebenar dan berterusan n Ia juga akan menjadi proses polytropic.
 Rajah 2. Kes -kes ciri -ciri yang berbeza dari proses termodinamik polytropic. Sumber: Wikimedia Commons.
Rajah 2. Kes -kes ciri -ciri yang berbeza dari proses termodinamik polytropic. Sumber: Wikimedia Commons. Aplikasi
Salah satu aplikasi utama persamaan polytropic adalah untuk pengiraan kerja yang dilakukan oleh sistem termodinamik tertutup, apabila ia berlalu dari keadaan awal ke ujung lain dalam cara kuasi, iaitu, berikutan penggantian keadaan keseimbangan.
Bekerja dalam proses polytropic untuk nilai n yang berbeza
Untuk n ≠ 1
Kerja mekanikal yang dijalankan oleh sistem termodinamik tertutup dikira dengan ekspresi:
W = ∫p.Dv
Boleh melayani anda: Diamagnetism: Bahan, Aplikasi, ContohDi mana p adalah tekanan dan v volume.
Seperti halnya proses polytropic, hubungan antara tekanan dan kelantangan adalah:
P.V n = tetap = c
Membersihkan p dari ungkapan sebelumnya untuk menggantikannya dalam ungkapan kerja:
P = c /V n
Anda mempunyai kerja mekanikal yang dilakukan semasa proses polytropic, yang bermula pada keadaan awal 1 dan berakhir di keadaan akhir 2. Semua ini muncul dalam ungkapan berikut:

\left&space;[V_2^1-n-V_1^1-n&space;\right&space;])
C = p1 V1n = P2 V2n
Dengan menggantikan nilai pemalar dalam ungkapan kerja diperolehi:
W = (p2 V2 - P1 V1)/(1-n)
Sekiranya bahan kerja boleh dimodelkan sebagai gas yang ideal, persamaan negeri berikut mempunyai:
P.V = m.R.T
Di mana m adalah bilangan tahi lalat gas ideal dan r adalah gas pemalar sejagat.
Untuk gas ideal yang mengikuti proses polytropic dengan indeks polytropy berbeza dari unit dan yang berlalu dari keadaan dengan suhu awal t1 ke negeri lain dengan suhu t2 Kerja yang dilakukan diberikan oleh formula berikut:
W = m r (t2 - T1)/(1-n)
Untuk n → ∞
Menurut formula untuk kerja yang diperolehi di bahagian sebelumnya, kerja proses polytropic dengan n = ∞ adalah null, kerana ungkapan kerja dibahagikan antara tak terhingga dan oleh itu hasilnya cenderung menjadi sifar.
Cara lain untuk mencapai hasil ini adalah bermula dari hubungan P1 V1n = P2 V2n, yang boleh ditulis semula seperti berikut:
(Ms1/P2) = (V2/V1)n
Mengambil akar n-thicker pada setiap ahli yang anda dapat:
(V2/V1) = (P1/P2)(1/n)
Sekiranya N → ∞, anda perlu (v2/V1) = 1, yang bermaksud:
Boleh melayani anda: Haba yang disebut: formula, bagaimana mengira dan diselesaikan latihanV2 = V1
Iaitu, kelantangan tidak berubah dalam proses polytropic dengan n → ∞. Oleh itu perbezaan isipadu dv dalam integral kerja mekanikal adalah 0. Proses polytropic jenis ini juga dikenali sebagai proses Isocoric, o Proses pada jumlah tetap.
Untuk n = 1
Sekali lagi kita mempunyai ungkapan untuk bekerja:
W = ∫p dv
Dalam hal proses polytropic dengan n = 1, hubungan antara tekanan dan kelantangan adalah:
P v = malar = c
Dengan membersihkan p dari ungkapan sebelumnya dan menggantikan, anda mempunyai kerja yang dilakukan untuk pergi dari keadaan awal 1 ke keadaan akhir 2:

Iaitu:
W = c ln (v2/V1).
Oleh kerana keadaan awal dan akhir ditentukan dengan baik, begitu juga dengan CTTE. Iaitu:
C = p1 V1 = P2 V2
Akhirnya, ungkapan berguna berikut tersedia untuk mencari kerja mekanikal sistem tertutup polyitropic di mana n = 1.
W = p1 V1 ln (v2/V1) = P2 V2 ln (v2/V1)
Sekiranya bahan kerja terdiri daripada m Tahi lalat gas ideal, maka persamaan gas ideal boleh digunakan: p v = m.R.T.
Dalam kes ini, seperti p.V1 = CTTE, proses polytropic dengan n = 1 adalah proses pada suhu T malar (isotermal), supaya ungkapan berikut untuk kerja dapat diperoleh:
W = m r t1 ln (v2/V1) = m r t2 ln (v2/V1)
 Rajah 3. Contoh pencairan karamban, contoh proses isoterma. Sumber: Pixabay.
Rajah 3. Contoh pencairan karamban, contoh proses isoterma. Sumber: Pixabay. Contoh proses polytropic
- Contoh 1
Anggapkan silinder dengan omboh bergerak penuh dengan satu kilogram udara. Pada mulanya udara menduduki volum v1= 0.2 m3 pada tekanan p1= 400 kPa. Proses polytropic diikuti dengan n = γ = 1.4, keadaan terakhirnya mempunyai tekanan p2 = 100 kPa. Tentukan kerja yang dilakukan oleh udara di omboh.
Penyelesaian
Apabila indeks polytropy sama dengan pemalar adiabatik, terdapat proses di mana bahan kerja (udara) tidak bertukar haba dengan alam sekitar, dan oleh itu tidak mengubah entropi.
Ia boleh melayani anda: Undang -undang termodinamik ketiga: formula, persamaan, contohUntuk udara, gas diatomik yang ideal, anda mempunyai:
γ = cp/cv, dengan cp = (7/2) r dan cv = (5/2) r
Jadi:
γ = 7/5 = 1.4
Menggunakan ungkapan proses polytropic, jumlah akhir udara dapat ditentukan:
V2 = [P2 V11.4)/P2](1/1.4) = 0.54 m3.
Sekarang ada syarat untuk memohon formula kerja yang dilakukan dalam proses polytropic untuk n ≠ 1 yang diperolehi di atas:
W = (p2 V2 - P1 v1)/(1-n)
Menggantikan nilai yang sesuai adalah:
W = (100 kPa 0.54 m3 - 400 kPa 0.2 m3)/(1 - 1.4) = 65.4 kJ
- Contoh 2
Anggapkan silinder yang sama Contoh 1, dengan omboh bergerak penuh dengan satu kilogram udara. Pada mulanya udara menduduki jumlah v1 = 0.2 m3 pada tekanan P1 = 400 kPa. Tetapi tidak seperti kes sebelumnya, udara mengembang secara isothermically untuk mencapai tekanan akhir P2 = 100 kPa. Tentukan kerja yang dilakukan oleh udara di omboh.
Penyelesaian
Seperti yang dilihat sebelum ini, proses isoterma adalah proses polytropic dengan indeks n = 1, jadi ia dipenuhi bahawa:
P1 v1 = p2 v2
Dengan cara ini, jumlah akhir dapat dengan mudah terpisah untuk mendapatkan:
V2 = 0.8 m3
Kemudian menggunakan ekspresi kerja yang diperoleh sebelum ini untuk kes n = 1 anda perlu bekerja dengan udara di omboh dalam proses ini adalah:
W = P1 V1 Ln (V2/V1) = 400000 Pa × 0.2 m3 LN (0.8/0.2) = 110.9 kJ.
Rujukan
- Bauer, w. 2011. Fizik untuk Kejuruteraan dan Sains. Jilid 1. MC Graw Hill.
- Cengel, dan. 2012. Thermodynamics. Edisi ke -7. McGraw Hill.
- Figueroa, d. (2005). Siri: Fizik untuk Sains dan Kejuruteraan. Jilid 4. Cecair dan termodinamik. Diedit oleh Douglas Figueroa (USB).
- López, c. Undang -undang termodinamik pertama. Pulih dari: Culturacientifica.com.
- Knight, r. 2017. Fizik untuk saintis dan kejuruteraan: Pendekatan Strategi. Pearson.
- Serway, r., Vulle, c. 2011. Asas Fizik. 9NA ed. Pembelajaran Cengage.
- Sevilla University. Mesin terma. Pulih dari: Laplace.kita.adalah.
- Wikiwand. Proses Politropik. Pulih dari: wikiwand.com.
- « Kajian Penyelidikan Apa, Jenis dan Contoh
- Penyebaran Topik Penyelidikan Apa yang terdiri dan contohnya »

