Sifat berkala unsur -unsur dan ciri -ciri mereka

- 1747
- 370
- Horace Gulgowski
The Sifat berkala unsur -unsur Mereka adalah mereka yang menentukan tingkah laku fizikal dan kimia mereka dari perspektif atom, dan magnitudnya, sebagai tambahan kepada nombor atom, membenarkan klasifikasi atom.
Dari semua sifat, ini dicirikan, seperti namanya, kerana mereka berkala; Iaitu, jika jadual berkala dikaji, dapat diperakui bahawa magnitinya mematuhi trend yang bertepatan dan berulang dengan pesanan unsur -unsur dalam tempoh (baris) dan kumpulan (lajur).
 Berkala intrinsik sebahagian daripada unsur -unsur jadual berkala. Sumber: Gabriel Bolívar.
Berkala intrinsik sebahagian daripada unsur -unsur jadual berkala. Sumber: Gabriel Bolívar. Sebagai contoh, jika anda mengembara tempoh berkala dan harta berkurangan dengan magnitud dengan setiap elemen, perkara yang sama akan berlaku dalam semua tempoh. Sebaliknya, jika turun kumpulan atau lajur, ia meningkatkan magnitudnya, yang sama dapat dijangkakan untuk kumpulan lain.
Dan dengan itu, variasi mereka diulang dan membuktikan trend mudah yang bersetuju dengan pesanan unsur -unsur untuk nombor atom mereka. Ciri -ciri ini bertanggungjawab secara langsung untuk sifat -sifat metalik atau tidak -logam unsur -unsur, serta reaktiviti mereka, yang telah membantu mengklasifikasikannya dengan lebih mendalam.
Sekiranya seketika identiti unsur -unsur tidak diketahui dan mereka dilihat sebagai "sfera" yang pelik, jadual berkala boleh dibina semula (dengan banyak kerja) menggunakan sifat -sifat ini.
Dengan cara ini, sfera yang sepatutnya akan memperoleh warna yang membolehkan mereka membezakannya dari satu sama lain dalam kumpulan (imej unggul). Mengetahui ciri elektronik mereka, mereka dapat mengatur dalam tempoh, dan kumpulan akan mengkhianati mereka yang mempunyai bilangan elektron valensi yang sama.
Pembelajaran dan penalaran sifat berkala adalah sama dengan mengetahui mengapa unsur -unsur bertindak balas dalam satu cara atau yang lain; Ia mengetahui mengapa unsur -unsur logam berada di kawasan tertentu di meja, dan unsur -unsur bukan logam di lain.
[TOC]
Apakah sifat berkala dan ciri -ciri mereka
-Radio atom
Semasa memerhatikan imej, perkara pertama yang dapat diperhatikan adalah bahawa tidak semuanya adalah saiz yang sama. Ada yang lebih besar daripada yang lain. Sekiranya diperhatikan dengan lebih terperinci, ia akan didapati bahawa saiz -saiz ini berbeza -beza mengikut corak: dalam tempoh ia berkurangan dari kiri ke kanan, dan dalam kumpulan meningkat dari atas ke bawah.
Di atas juga boleh dikatakan dengan cara ini: jejari atom berkurangan ke arah kumpulan atau lajur kanan, dan peningkatan dalam tempoh atau baris yang lebih rendah. Oleh itu, jejari atom adalah harta berkala pertama, kerana variasinya mengikuti corak dalam unsur -unsur.
Beban nuklear vs elektron
Apakah corak ini? Dalam tempoh elektron atom menduduki tahap tenaga yang sama, yang berkaitan dengan jarak yang memisahkannya dari nukleus. Apabila kita bergerak dari satu kumpulan ke kumpulan yang lain (yang sama dengan perjalanan ke kanan), nukleus menambah kedua -dua elektron dan proton dalam tahap tenaga yang sama.
Boleh melayani anda: KarbonOleh itu, elektron tidak dapat menduduki jarak jauh dari nukleus, yang meningkatkan beban positifnya kerana ia mempunyai lebih banyak proton. Oleh itu, elektron mengalami daya tarikan yang lebih besar ke arah nukleus, menarik mereka semakin banyak kerana bilangan proton meningkat.
Itulah sebabnya unsur -unsur di hujung kanan jadual berkala (lajur kuning dan biru) mempunyai radio atom yang lebih kecil.
Sebaliknya, apabila "melompat" dari satu tempoh ke satu sama lain (yang sama untuk mengatakan bahawa satu kumpulan turun), tahap tenaga yang dibolehkan baru membolehkan elektron untuk menduduki lebih banyak ruang yang jauh di dalam nukleus. Lebih jauh lagi, nukleus (dengan lebih banyak proton) menarik mereka dengan kurang daya; Dan radio atom itu meningkat.
Radio Ionik
Radio ionik mematuhi corak yang serupa dengan radio atom; Walau bagaimanapun, ini tidak banyak bergantung pada nukleus, tetapi berapa banyak elektron atau kurang mempunyai atom berkenaan dengan keadaan neutralnya.
Kation (Na+, Ac2+, Kepada3+, Menjadi2+, Iman3+) mempamerkan beban positif kerana mereka telah kehilangan satu atau lebih elektron, dan oleh itu, nukleus menarik mereka dengan kekuatan yang lebih besar kerana terdapat kurang penolakan di antara mereka. Hasilnya: kation lebih kecil daripada atom dari mana mereka memperoleh.
Dan untuk anion (atau2-, F-, S2-, Yo-) Sebaliknya, mereka mempamerkan beban negatif kerana ia mempunyai satu atau lebih elektron yang berlebihan, meningkatkan penolakannya antara satu sama lain di atas tarikan yang dikenakan oleh nukleus. Hasilnya: Anion lebih besar daripada atom dari mana ia diperoleh (imej yang lebih rendah).
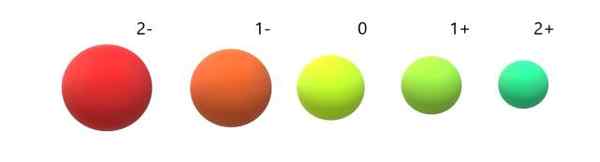 Variasi radio ionik berkenaan dengan atom neutral. Sumber: Gabriel Bolívar.
Variasi radio ionik berkenaan dengan atom neutral. Sumber: Gabriel Bolívar. Dapat dilihat bahawa anion 2- adalah yang paling besar dari semua, dan kation 2+ yang terkecil. Radio meningkat apabila atom dicas secara negatif, dan kontrak apabila ia dikenakan secara positif.
-Elektronegativiti
Apabila unsur -unsur mempunyai radio atom kecil, bukan sahaja elektron mereka tertarik dengan sangat, tetapi juga elektron atom jiran ketika membentuk ikatan kimia. Kecenderungan ini untuk menarik elektron atom lain dalam sebatian adalah apa yang dikenali sebagai elektronegativiti.
Yang kecil atom tidak bermaksud bahawa ia akan menjadi lebih banyak elektronegatif. Jika ya, elemen helium dan hidrogen akan menjadi atom elektronegatif. Helium ke mana sains telah menunjukkan, tidak membentuk pautan kovalen apa -apa jenis; Dan hidrogen, hampir tidak mempunyai proton tunggal dalam nukleus.
Boleh melayani anda: tembaga sulfida: struktur, sifat, kegunaanApabila radio atom besar, nukleus tidak mempunyai kekuatan yang cukup untuk menarik elektron atom lain; Oleh itu, unsur -unsur elektronegatif yang paling banyak adalah mereka yang mempunyai jejari atom kecil dan bilangan proton yang lebih besar.
Sekali lagi, mereka yang memenuhi ciri -ciri ini dengan sempurna adalah unsur -unsur bukan logam blok P dari jadual berkala; Ini adalah milik kumpulan 16 atau oksigen (o, s, se, te, po), dan kumpulan 17 atau fluorin (f, cl, br, i, di).
Trend
Menurut segala yang dikatakan, unsur -unsur elektronegatif yang paling banyak terletak di sudut kanan atas jadual berkala; mempunyai fluorida sebagai elemen yang membawa senarai yang paling elektronegatif.
Kerana? Tanpa menggunakan skala elektronegativiti (Pauling, Mulliken, dll.), fluoror walaupun lebih besar daripada neon (gas mulia dalam tempohnya), yang pertama boleh membentuk pautan sementara yang kedua tidak. Di samping.
-Watak logam
Sekiranya elemen mempunyai jejari atom berbanding dengan tempoh yang sama, dan ia juga sedikit elektronegatif, ia adalah logam, dan mempunyai watak logam yang tinggi.
Sekiranya kita kembali ke imej utama, sfera kemerahan dan kehijauan, seperti kelabu, sesuai dengan elemen logam. Logam mempunyai ciri -ciri yang unik, dan dari sini sifat berkala dengan sifat fizikal dan makroskopik bahan mula saling berkaitan.
Unsur -unsur dengan watak logam yang tinggi dicirikan oleh atom mereka yang agak besar, mudah kehilangan elektron kerana nukleus hampir tidak dapat menarik mereka ke arah mereka.
Akibatnya, mereka mengoksidakan atau kehilangan elektron dengan mudah untuk membentuk kation, m+; Ini tidak bermaksud bahawa semua kation adalah logam.
Trend
Pada ketika ini, anda boleh meramalkan bagaimana watak logam dalam jadual berkala berbeza -beza. Jika diketahui bahawa logam mempunyai radio logam besar, dan terdapat juga beberapa elektronegatif, unsur -unsur paling berat (tempoh yang lebih rendah) harus dijangkakan, menjadi yang paling logam; dan unsur -unsur yang lebih ringan (tempoh atas), metalik paling sedikit.
Begitu juga, watak logam mengurangkan electronegatif yang lebih banyak elemen dibuat. Ini bermakna melawat tempoh dan kumpulan di sebelah kanan jadual berkala, dalam tempoh yang lebih tinggi, akan memenuhi unsur -unsur metalik yang paling sedikit.
Oleh itu, watak logam meningkat dengan turun oleh kumpulan, dan berkurangan ke kanan ke kanan dalam tempoh yang sama. Antara unsur -unsur logam yang kita ada: Na (natrium), li (litium), mg (magnesium), Ba (barium), ag (perak), au (emas), po (polonio), pb (plumbum), cd (kadmium ), Kepada (aluminium), dll.
Boleh melayani anda: titik mendidih: konsep, pengiraan dan contoh-Tenaga pengionan
Sekiranya atom mempunyai jejari atom yang besar, diharapkan nukleusnya tidak menyimpan elektron menjadi kekuatan yang besar di lapisan terluar. Akibatnya, menghapuskan mereka dari atom dalam fasa gas (individu) tidak memerlukan banyak tenaga; Ini adalah, tenaga pengionan, EI, perlu mengambil elektron.
Yang juga sama dengan mengatakan bahawa ia adalah tenaga yang mesti dibekalkan untuk mengatasi daya tarikan nukleus atom atau gas ion pada elektron paling luarnya. Semakin kecil atom dan lebih banyak elektronegatif, semakin rendahnya; Ini adalah kecenderungan anda.
Persamaan berikut menggambarkan contoh:
Na (g) => na+(g) + e-
Yang perlu untuk mencapai matlamat ini tidak begitu hebat berbanding pengionan kedua:
Na+(g) => na2+(g) + e-
Sejak di NA+ Caj positif mendominasi dan ion lebih kecil daripada atom neutral. Akibatnya, nukleus NA+ menarik dengan kekuatan yang jauh lebih besar kepada elektron, jadi ia memerlukan yang lebih besar.
-Affinity Elektronik
Dan akhirnya, terdapat harta berkala dari pertalian elektronik. Ini adalah trend tenaga yang mempunyai atom elemen fasa gas untuk menerima elektron. Sekiranya atom kecil dan mempunyai teras dengan daya tarikan yang besar, mudah bagi anda untuk menerima elektron, membentuk anion yang stabil.
Semakin stabil anion berkenaan dengan atom neutralnya, semakin besar pertalian elektroniknya. Walau bagaimanapun, penolakan antara elektron yang sama juga dimainkan.
Nitrogen, misalnya, mempunyai pertalian elektronik yang lebih besar daripada oksigen. Ini kerana tiga elektron 2p mereka hilang dan menangkis kurang antara satu sama lain dan elektron masuk; Semasa dalam oksigen, terdapat sepasang elektron berpasangan yang menimbulkan penolakan elektronik yang lebih besar; Dan di fluorida, terdapat dua pasang.
Oleh sebab itu, trend dalam pertalian elektronik dikatakan dinormalisasi dari tempoh ketiga jadual berkala.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Prof. Ortega Graciela m. (1 April 2014). Sifat berkala unsur -unsur. Warna ABC. Diperolehi dari: ABC.com.Py
- Kimia Librettexts. (7 Jun, 2017). Sifat tempoh unsur -unsur. Pulih dari: chem.Libretxts.org
- Helmestine, Anne Marie, Ph.D. (2 Januari 2019). Sifat berkala unsur -unsur. Pulih dari: Thoughtco.com
- Toppr. (s.F.). Sifat tempoh elemen. Pulih dari: TOPPR.com /
- Sifat berkala unsur -unsur: Perjalanan di seberang meja adalah perjalanan melalui kimia. [Pdf]. Pulih dari: cod.Edu

