Titik kesetaraan

- 715
- 158
- Horace Gulgowski
 Titik kesetaraan adalah kepekatan nilai tambah stoikiometrik yang sama dengan jumlah analit
Titik kesetaraan adalah kepekatan nilai tambah stoikiometrik yang sama dengan jumlah analit Apakah titik kesetaraan?
Dia titik kesetaraan Ia adalah satu di mana dua bahan kimia telah bertindak balas sepenuhnya. Dalam tindak balas asid, titik ini menunjukkan apabila keseluruhan asid atau asas telah dinetralkan.
Konsep ini setiap hari dalam darjah atau penilaian volumetrik, dan ditentukan oleh pengiraan matematik yang mudah.
Dalam hal ini, ijazah adalah proses di mana jumlah penyelesaian kepekatan yang diketahui ditambah dengan teliti, dipanggil titular, kepada penyelesaian kepekatan yang tidak diketahui, untuk mendapatkan kepekatannya.
Penggunaan penunjuk pH membolehkan mengetahui masa di mana tahapnya berakhir. Penunjuk ditambah kepada penyelesaian yang berjudul untuk melakukan kuantifikasi kepekatan yang anda ingin tahu.
Penunjuk asid-asas adalah sebatian kimia yang warna bergantung pada kepekatan hidrogen atau pH medium.
Perubahan warna penunjuk menunjukkan titik akhir ijazah, walaupun bukan titik kesetaraan. Sebaik -baiknya, kedua -dua titik mesti bertepatan, tetapi pada hakikatnya, perubahan warna boleh berlaku beberapa titisan selepas peneutralan asid atau asas telah selesai.
Apakah titik kesetaraan?
Penyelesaian asid kepekatan yang tidak diketahui yang diletakkan dalam sebotol.
Pemilihan penunjuk mesti dibuat sedemikian rupa sehingga ia mengubah warna pada titik bahawa jumlah yang sama dengan setara kimia penyelesaian titrating dan penyelesaian kepekatan yang tidak diketahui telah bertindak balas.
Ini adalah titik kesetaraan, sementara titik di mana penunjuk perubahan warna dipanggil titik akhir, di mana titling berakhir.
Boleh melayani anda: Penyelesaian hipotonik: komponen, penyediaan, contohTitik terakhir
Pengionan atau pemisahan penunjuk diwakili seperti berikut:
Hin +h₂o masuk- + H3Sama ada+
Dan oleh itu mempunyai ka yang tetap
Ka = [h3Sama ada+] [Dalam-] / [Hin]
Hubungan antara penunjuk yang tidak diselaraskan (HIN) dan penunjuk yang dipisahkan (dalam-) Menentukan warna penunjuk.
Penambahan asid meningkatkan kepekatan hin dan menghasilkan warna 1 penunjuk. Sementara itu, penambahan asas menyokong peningkatan kepekatan penunjuk yang dipisahkan (dalam-) (Warna 2).
Adalah wajar bahawa titik kesetaraan bertepatan dengan titik akhir. Untuk melakukan ini, penunjuk dipilih dengan selang perubahan warna yang merangkumi titik kesetaraan. Di samping itu, ia adalah mengenai mengurangkan sebarang kesilapan yang menghasilkan perbezaan antara titik kesetaraan dan titik akhir.
Penyeragaman atau penilaian penyelesaian adalah proses di mana kepekatan sebenar penyelesaian ditentukan. Ia secara metodologi adalah ijazah, tetapi strategi diikuti adalah berbeza.
Penyelesaian standard utama diletakkan di dalam kelalang dan penyelesaian titular yang diseragamkan ditambah dengan burette.
Kesetaraan titrasi asid kuat dengan asas yang kuat
100 ml 0.1 M HCl diletakkan di dalam kelalang dan ditambah secara beransur -ansur, dengan cara burette, larutan 0.1 M NaOH, menentukan perubahan pH penyelesaian yang menyebabkan asid hidroklorik.
Pada mulanya, sebelum menambah NaOH, pH penyelesaian HCl adalah 1.
Pangkalan yang kuat (NaOH) ditambah dan pH secara beransur -ansur meningkat, tetapi ia tetap pH berasid, kerana asid berlebihan menentukan pH ini.
Boleh melayani anda: kalium iodida (ki): struktur, sifat, mendapatkan, menggunakan, risikoSekiranya NaOH berterusan, ada masa apabila titik kesetaraan dicapai, di mana pH adalah neutral (pH = 7). Asid telah bertindak balas dengan asas yang memakan, tetapi belum ada lebihan asas.
Kepekatan natrium klorida mendominasi, yang merupakan garam neutral (atau NA+ atau cl- dihidrolisis).
Sekiranya NaOH berterusan, pH terus meningkat, menjadi lebih asas daripada titik kesetaraan, kerana kepekatan NaOH mendominasi.
Sebaik -baiknya, perubahan warna penunjuk harus berlaku pada ph = 7, tetapi disebabkan oleh bentuk mendadak lengkung titling, phenolphthalein boleh digunakan yang berubah menjadi warna merah jambu pucat ke pH sekitar 8.
Lengkung ijazah berasaskan jatuh berasaskan kejatuhan
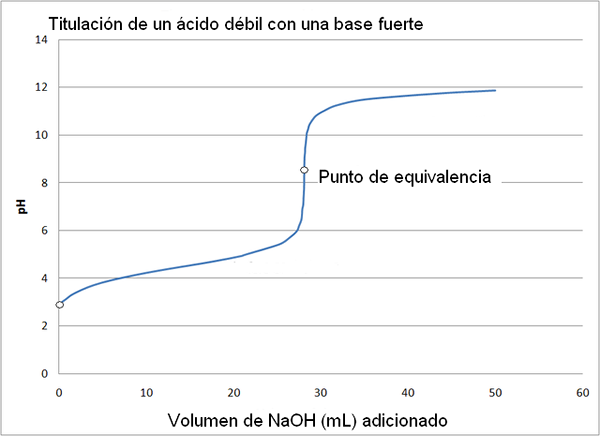 Asid lemah dan lengkung titrasi asas yang kuat. Sumber: Wikimedia Commons
Asid lemah dan lengkung titrasi asas yang kuat. Sumber: Wikimedia Commons Lengkung titrasi asid kuat dengan asas yang kuat adalah serupa dengan imej atas. Satu -satunya perbezaan antara kedua -dua lengkung adalah bahawa yang pertama mempunyai perubahan pH yang lebih mendadak, sementara dalam lengkung titrasi asid lemah dengan asas yang kuat, dapat dilihat bahawa perubahan itu lebih beransur -ansur.
Dalam kes ini asid lemah bertajuk, seperti asid asetik (CH3COOH) dengan asas yang kuat, natrium hidroksida (NaOH). Reaksi yang berlaku dalam ijazah boleh skema seperti berikut:
NaOH +Ch3Cooh => ch3COO-Na+ + H₂o
Dalam kes ini, penyelesaian penampan asetat dibentuk dengan PKA = 4.74. Kawasan kusyen dapat dilihat dalam perubahan yang sedikit dan hampir tidak dapat dilihat sebelum pH 6.
Ia boleh melayani anda: kumpulan amino (NH2): struktur, sifat, contohTitik kesetaraan, seperti yang ditunjukkan oleh imej, adalah sekitar 8.72 dan bukan 7. Ini kerana cho3COO- Ia adalah anion yang selepas hydrolyzar menjana oh-, yang mendasari ph:
Ch3COO- + H₂o Ch3COOH +OH-
Peringkat
Titrasi asid asetik oleh natrium hidroksida boleh dibahagikan kepada 4 peringkat untuk analisis.
- Sebelum mula menambah asas (NaOH), pH larutan adalah berasid dan bergantung kepada pemisahan asid asetik.
- Oleh kerana natrium hidroksida ditambah, penyelesaian redaman asetat terbentuk, tetapi dengan cara yang sama pembentukan asas asetat konjugasi meningkat, yang membawa dengan peningkatan penyelesaian larutan penyelesaiannya.
- PH titik kesetaraan berlaku ke pH 8.72, yang terus terang alkali.
Titik kesetaraan tidak mempunyai nilai malar dan berbeza -beza bergantung pada sebatian yang terlibat dalam tahap.
- Dengan terus menambah NaOH, setelah mencapai titik kesetaraan, pH semakin meningkat disebabkan oleh natrium hidroksida yang berlebihan.
Pemilihan penunjuk mengikut titik kesetaraan
Phenolphthalein berguna dalam menentukan titik kesetaraan dalam tahap ini, kerana ia mempunyai titik giliran warna dalam pH sekitar 8, yang jatuh ke dalam kawasan pH titrasi asid asetik yang merangkumi kesetaraan titik (pH = 8.72).
Sebaliknya, metil merah tidak berguna dalam menentukan titik kesetaraan, kerana ia mengubah warna pada selang pH 4.5 hingga 6.4.
Rujukan
- Helmestine, Anne Marie. Definisi titik kesetaraan. Pulih dari pemikiran.com
- Perbezaan antara titik akhir dan titik kesetaraan. Diperolehi dari perbezaan antara.jaring
- Titik Kesetaraan: Definisi & Pengiraan. Kajian pulih.com

