Apa itu berkala kimia?
- 3888
- 1071
- Ms. Santos Fritsch
The Berkala kimia Ia adalah trend atau corak yang mempamerkan unsur -unsur kimia untuk satu set sifat kimia dan fizikal mereka. Ia menjadi sejenis persaudaraan, yang merupakan panduan asas bagi ibu bapa kimia untuk menganjurkan dan mengklasifikasikan semua elemen dalam jadual berkala yang diketahui hari ini.
Unsur -unsur yang ada (antara semula jadi dan buatan) tetap, pada tahap yang berbeza, hubungan antara satu sama lain yang mentakrifkan mereka dalam keluarga atau kumpulan. Pada mulanya ini dibenarkan untuk menggambarkan reaktiviti unsur -unsur, serta jenis sebatian yang membentuk; Dan lebih baik, meramalkan sifat mereka yang belum ditemui.
 Unsur -unsur jadual berkala
Unsur -unsur jadual berkala Kemudian, sementara abad kedua puluh dan fizik berkembang, sifat -sifat ini dikaitkan dengan struktur elektronik atom. Oleh itu, elektron menandakan berkala kimia berkenaan dengan unsur -unsur, tetapi tidak begitu banyak untuk isotop dan kestabilan relatif mereka.
Terima kasih kepada berkala kimia adalah mungkin untuk memahami mengapa unsur -unsur diposisikan dalam kumpulan yang sama dalam jadual berkala. Ia juga membolehkan ramalan sifat kimia, dan juga fizikal, di antara unsur -unsur jisim atom yang berbeza.
[TOC]
Corak dan kumpulan
 Seperti corak zigzagging awan ini, sifat -sifat unsur -unsur menunjukkan kecenderungan berkala dan ciri. Sumber: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Seperti corak zigzagging awan ini, sifat -sifat unsur -unsur menunjukkan kecenderungan berkala dan ciri. Sumber: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Periodicity kimia diperhatikan, seperti yang dijangkakan, dalam sifat berkala. Ini dicirikan oleh kecenderungan nilai mereka kerana mereka dinilai dalam tempoh atau kumpulan berkala.
Zigzag, gergaji atau gunung curam boleh dipilih untuk tujuan perbandingan: dengan naik turun. Iaitu, sifat berkala mempunyai minimum dan maksimum untuk unsur -unsur tertentu. Dan kedudukan relatif unsur -unsur ini sesuai, cemerlang, dengan lokasi dalam kumpulan masing -masing.
Itulah sebabnya berkala kimia berguna untuk menganalisisnya berdasarkan kumpulan; Walau bagaimanapun, tempoh adalah penting untuk visi lengkap trend.
Boleh melayani anda: kalium karbonat (k2co3): struktur, sifat, kegunaan, memperolehIa akan dilihat dengan contoh -contoh berkala berikut dalam kimia, yang bukan sahaja keuntungan dalam sifat berkala, tetapi juga dalam sebatian bukan organik dan, inklusif, organik.
Tenaga pengionan
Tenaga pengionan, adalah, adalah salah satu sifat berkala yang paling cemerlang. Semakin besar atom unsur, semakin mudah salah satu elektron terakhirnya adalah untuk dikeluarkan; iaitu, orang -orang Valencia. Oleh itu: atom dengan radio kecil akan mempunyai besar, sementara atom dengan radio besar, mereka akan mempunyai kecil.
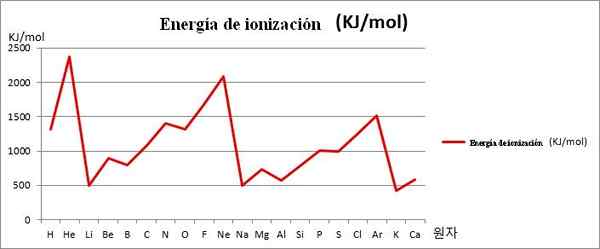 EI vs Graphics. 20 elemen kimia pertama. Sumber: Kenneth.JH.Han/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0)
EI vs Graphics. 20 elemen kimia pertama. Sumber: Kenneth.JH.Han/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0) Perhatikan contohnya dalam imej di atas bahawa unsur -unsur li, na dan k, mempunyai anak kecil EI, itulah sebabnya mereka terletak di lembah atau dana grafik. Sementara itu, unsur -unsur dia, Ne dan Ar, ditemui di puncak atau titik yang lebih tinggi, kerana mereka sangat besar berhubung dengan unsur -unsur lain.
Unsur -unsur Li, Na dan K tergolong dalam kumpulan logam alkali, yang dicirikan oleh korban EI mereka. Sebaliknya, unsur -unsur dia, NE dan AR sesuai dengan gas mulia, dengan sangat tinggi, kerana atom mereka adalah yang terkecil di antara semua unsur untuk tempoh yang sama dalam jadual berkala.
Oleh itu, periodik kimia menunjukkan bahawa ia menurunkan kumpulan, tetapi meningkatkan tur dari kiri ke kanan.
Blok Hydros p
Contoh berkala kimia di luar sifat berkala yang kita lihat dalam hidror elemen blok p.
Sebagai contoh, kumpulan 15 terdiri daripada elemen n, p, as, sb dan bi dan bi. Sekiranya diketahui bahawa ammonia, NH3, Ia mempunyai nitrogen dengan bilangan pengoksidaan +3, maka mungkin dijangkakan, dengan berkala yang mudah, bahawa unsur -unsur yang tinggal juga mempunyai hidros yang sama. Dan sememangnya: NH3, Ph3, Abu3, SBH3 dan BiH3.
Boleh melayani anda: boron: sejarah, sifat, struktur, kegunaanSatu lagi kes yang serupa berlaku dengan kumpulan 16. Hidrida oksigen adalah h2Atau, air. Diharapkan, sekali lagi, bahawa unsur -unsur s, se, te dan po mempunyai hidror dengan formula yang sama, tetapi dengan sifat -sifat yang berbeza. Dan itu: H2S, h2Se, h2Te dan h2PO. Ini disebabkan oleh tempoh kimia.
Mungkin contoh yang paling mengagumkan difahami oleh karbon, silikon dan germanium hidros. Karbon hidrida adalah cho4, Dan silikon, sih4. Germanio, yang diramalkan oleh Mendeleev dengan nama Eka-Silicio (es), mestilah sebagai periodicity a hydride dengan formula geh4; ramalan yang akhirnya mengesahkan selepas penemuan dan kajian berikutnya.
Molekul halogen
Sekiranya diketahui bahawa fluorida berada dalam keadaan asas sebagai molekul m2, Kemudian diandaikan bahawa halogen lain (Cl, Br, I dan At) juga membentuk molekul diatomik. Dan itu, menjadi molekul CL2, Br2 dan saya2 Yang paling terkenal.
Oksida dan sulfida
Begitu juga seperti yang disebutkan dengan hidror blok p, Oksida dan sulfida untuk unsur -unsur kumpulan yang sama menunjukkan sejenis surat -menyurat dalam formula kimia masing -masing. Contohnya, lithium oksida adalah li2Atau, menjadi oksida untuk logam alkali lain atau kumpulan 1: na2BAIK2Atau, rb2O dan CS2Sama ada.
Ini kerana dalam semua mereka logam dengan bilangan pengoksidaan +1, berinteraksi dengan anion atau2-. Perkara yang sama berlaku dengan sulfida mereka: li2S, na2S, dll. Dalam kes logam alkalinoterulus atau kumpulan 2, formula oksida dan sulfida masing -masing: lebah dan BES, MGO dan MGS, CAO dan CAS, SRO dan SRS, BAO dan BAS.
Ia boleh melayani anda: asid selener (H2SO3): sifat, risiko dan kegunaanPeriodicity ini juga terpakai (sebahagiannya) untuk oksida unsur blok p: Co2, SIO2, Geo2, B2Sama ada3, Kepada2Sama ada3, Ga2Sama ada3, dan lain-lain. Walau bagaimanapun, untuk elemen blok d atau yang lain dari blok p, Berkala ini menjadi lebih rumit kerana nombor pengoksidaan tertinggi untuk elemen yang sama.
Contohnya, tembaga dan perak tergolong dalam kumpulan 11. Satu mempunyai dua oksida: Cuo (Cu2+) dan cu2Atau (cu+); Sementara yang lain hampir tidak mempunyai satu: dahulu (AG+).
Hidrokarbon dan silanes
Kedua-dua karbon dan silikon mempunyai keupayaan untuk membentuk ikatan C-C atau Si-Si, masing-masing. Bon C-C jauh lebih stabil, jadi struktur hidrokarbon boleh menjadi tidak seimbang dan bervariasi daripada rakan-rakan siltan mereka.
Kesimpulan ini disebabkan semula dengan berkala kimia. Contohnya, Ethane, Cho3Ch3 atau c2H6 Disilanum mempunyai rakan sejawatannya, sih3Ya h3 atau jika2H6.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Helmestine, Anne Marie, Ph.D. (26 Ogos, 2020). Definisi periody dalam kimia. Pulih dari: Thoughtco.com
- Dan. V. Babaev, & Ray Hefferlin. (s.F.). Konsep berkala kimia:
Dari Mendeleev Molecular Table Hyper-Monsiodicity Corak. Pulih dari: chem.MSU.Ru - Bunga ms., Theopold k., & Langley r. (s.F.). Periody. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Universiti Terbuka. (2020). Corak kimia dapat dijumpai dalam tempoh Jadual: Periodik Kimia. Pulih dari: buka.Edu
- « Konsep dan contoh keseimbangan yang stabil
- Sejarah Sosiologi Luar Bandar, Bidang Pengajian, Kepentingan »

