Radio atom
- 2721
- 832
- Kerry Schmitt
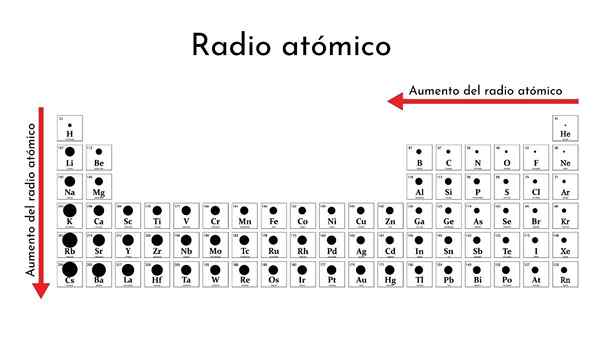
 Jadual berkala unsur -unsur dengan radio atom
Jadual berkala unsur -unsur dengan radio atom Apakah radio atom?
Dia Radio atom Ini adalah parameter penting bagi sifat berkala unsur -unsur jadual berkala. Ia secara langsung berkaitan dengan saiz atom, kerana radio yang lebih besar, lebih besar atau besar. Begitu juga, ia berkaitan dengan ciri -ciri elektronik yang sama.
Walaupun atom mempunyai lebih banyak elektron, semakin besar saiz atom dan radionya. Kedua -duanya ditakrifkan oleh elektron lapisan Valencia, kerana pada jarak di luar orbit mereka, kebarangkalian mencari elektron menghampiri sifar. Sebaliknya berlaku di sekitar nukleus: kebarangkalian mencari elektron meningkat.
 Pakej bola kapas. Cara di mana mereka dipadatkan mentakrifkan saiz dan radio mereka, dengan cara yang sama yang berlaku dengan atom
Pakej bola kapas. Cara di mana mereka dipadatkan mentakrifkan saiz dan radio mereka, dengan cara yang sama yang berlaku dengan atom Imej atas mewakili pembungkusan bola kapas. Perhatikan bahawa setiap satu dikelilingi oleh enam jiran, tidak mengira baris yang mungkin atau lebih rendah. Cara di mana bola kapas dipadatkan akan menentukan saiz mereka dan, oleh itu, radio mereka; Seperti atom.
Unsur -unsur mengikut sifat kimia mereka berinteraksi dengan atom mereka sendiri dalam satu cara atau yang lain. Oleh itu, magnitud jejari atom berbeza -beza mengikut jenis ikatan yang ada dan dengan pembungkusan pepejal atomnya.
Bagaimana jejari atom diukur?
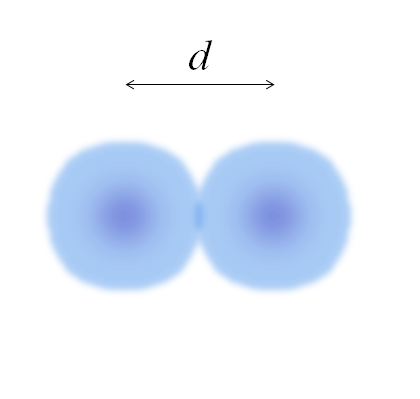 Imej dua atom, yang tepinya tidak ditakrifkan sepenuhnya. Sumber: Gabriel Bolívar
Imej dua atom, yang tepinya tidak ditakrifkan sepenuhnya. Sumber: Gabriel Bolívar Dalam gambar sebelumnya, ia boleh menjadi mudah. Walau bagaimanapun, bidang atom tidak ditakrifkan sepenuhnya. Kerana? Kerana elektron beredar dan kabur di kawasan konkrit ruang: orbital.
Oleh itu, atom boleh dianggap sebagai sfera dengan tepi yang tidak dapat dipertikaikan, yang mustahil untuk mengatakan dengan pasti di mana mereka berakhir. Sebagai contoh, dalam imej yang unggul rantau pusat, dekat dengan nukleus, kelihatan warna yang lebih sengit, sementara tepinya kabur.
Boleh melayani anda: solvationImej mewakili molekul diatomik dan2 (Seperti CL2, H2, Sama ada2, dan lain-lain.). Dengan mengandaikan bahawa atom adalah badan sfera, jika jarak ditentukan d Itu memisahkan kedua -dua nukleus dalam pautan kovalen, kemudiannya cukup untuk membahagikannya menjadi dua bahagian (d/2) untuk mendapatkan jejari atom; Lebih tepat lagi, jejari kovalen E untuk E2.
Bagaimana jika E tidak membentuk ikatan kovalen dengan dirinya sendiri, tetapi ia adalah elemen logam? Jadi d Ia akan ditunjukkan oleh bilangan jiran yang mengelilingi E dalam struktur logam mereka; iaitu, dengan nombor koordinasi (n.C) atom di dalam pembungkusan (ingat bola kapas imej).
Penentuan jarak internuclear
Untuk menentukan d, yang merupakan jarak internuclear untuk dua atom dalam molekul atau pembungkusan, teknik analisis fizikal diperlukan.
Salah satu yang paling banyak digunakan ialah difraksi x -ray. Ia memancarkan rasuk cahaya melalui kaca, dan corak difraksi yang terhasil daripada interaksi antara elektron dan radiasi elektromagnet dikaji.
Bergantung pada pembungkusan, corak difraksi yang berbeza dapat diperolehi dan, oleh itu, nilai -nilai lain d.
Jika atom "ketat" dalam rangkaian kristal, mereka akan membentangkan nilai yang berbeza dari d Berbanding dengan mereka yang akan mempunyai jika mereka "selesa".
Begitu juga, jarak internuclear ini boleh berkisar dari nilai, jadi jejari atom sebenarnya terdiri daripada nilai purata pengukuran sedemikian.
Bagaimana jejari atom dan nombor koordinasi berkaitan? V. Goldschmidt mewujudkan hubungan antara keduanya, di mana untuk n.C of 12, nilai relatif ialah 1; daripada 0.97 untuk pembungkusan di mana atom mempunyai n.C sama dengan 8; daripada 0.96, untuk n.C sama dengan 6; dan 0.88 untuk n.C dari 4.
Boleh melayani anda: Natrium permanganat (NAMNO4): Hartanah, risikoUnit
Dari nilai untuk n.C sama dengan 12, banyak jadual telah dibina di mana radio atom semua elemen jadual berkala dibandingkan.
Kerana tidak semua elemen membentuk struktur padat (n.C kurang daripada 12), nisbah V digunakan. Goldschmidt untuk mengira radio atom mereka dan menyatakannya untuk pembungkusan yang sama. Dengan cara ini pengukuran radio atom diseragamkan.
Tetapi unit apa yang dinyatakan dalam? Diberi d Ia adalah magnitud yang sangat kecil, unit angstrom Å (10 ∙ 10-10m) atau juga digunakan secara meluas, picometer (10 ∙ 10-12m).
Bagaimana anda berubah dalam jadual berkala?
Dalam tempoh
Radio atom yang ditentukan untuk unsur -unsur logam dipanggil radio logam, manakala bagi unsur -unsur bukan metal, radio kovalen (seperti fosforus, p4, atau belerang, s8). Walau bagaimanapun, antara kedua -dua jenis radio terdapat perbezaan yang lebih menonjol daripada namanya.
Dari kiri ke kanan dalam tempoh yang sama, nukleus menambah proton dan elektron, tetapi yang terakhir ini terhad kepada tahap tenaga yang sama (nombor kuantum utama).
Akibatnya, nukleus menjalankan beban nuklear yang semakin meningkat pada elektron valensi, yang kontrak jejari atom.
Dengan cara ini, unsur -unsur bukan logam dalam tempoh yang sama cenderung mempunyai radio atom (kovalen) yang lebih kecil.
Turun oleh kumpulan
Apabila turun oleh kumpulan, tahap tenaga baru diaktifkan, yang membolehkan elektron mempunyai lebih banyak ruang. Oleh itu, awan elektronik merangkumi jarak yang lebih jauh, pinggir kaburnya lebih banyak daripada nukleus, dan, oleh itu, jejari atom berkembang.
Boleh melayani anda: kumpulan hidroksilPenguncupan Lantanide
Elektron lapisan dalaman membantu menyinari beban nuklear yang berkesan pada elektron valensi. Apabila orbital yang membentuk lapisan dalaman mempunyai banyak "lubang" (nod), seperti dengan orbital f, nukleus sangat mengikat jejari atom akibat kesan perisai miskin dari mereka.
Fakta ini dibuktikan dalam penguncupan lantanida dalam tempoh 6 jadual berkala. Dari HF terdapat penguncupan yang besar dari produk radius atom dari orbital f, yang "diisi" sebagai blok F: Lantanoides dan actinoids dilalui.
Kesan yang sama juga boleh diperhatikan dengan unsur -unsur blok P dari Tempoh 4. Kali ini produk kesan perisai yang lemah dari orbital d yang diisi dengan mengembara tempoh logam peralihan.
Contoh radio atom
Untuk tempoh 2 jadual berkala, radio atom unsur -unsurnya adalah:
-Li: 257 petang
-BE: 112 PM
-B: 88 malam
-C: 77 malam
-N: 74 malam
-O: 66 petang
-F: 64 malam
Perhatikan bahawa logam litium mempunyai jejari atom terbesar (257 petang), manakala fluorin, yang terletak di hujung kanan tempoh, adalah yang terkecil dari mereka semua (64 petang). Jejari atom turun dari kiri ke kanan dalam tempoh yang sama, dan nilai penyenaraian menunjukkannya.
Lithium, dengan membentuk ikatan logam, jejarinya adalah logam; dan fluorida, sebagai bentuk ikatan kovalen (f-f), jejarnya adalah kovalen.
Bagaimana jika anda ingin menyatakan radio atom di unit angstrom? Ia akan cukup untuk membahagikannya dengan 100: (257/100) = 2.57å. Dan sebagainya dengan sisa nilai.
Rujukan
- Kimia 301. Radii atom. Pulih dari: CH301.cm.Utexas.Edu
- Yayasan CK-12 (2016). Jejari atom. Pulih dari: chem.Libretxts.org
- Trend dalam jejari atom. Diambil dari: intro.Chem.Okstate.Edu
- Kolej Komuniti Clackamas (2002). Saiz atom. Diperolehi dari: DL.Clackamas.Edu
- Clark J. (2012). Jejari atom dan ionik. Pulih dari: chemguide.co.UK
- Shiver & Atkins. (2008). Kimia Inorganik (Edisi Keempat, ms. 23, 24, 80, 169). MC Graw Hill.

