Struktur radio, sifat, kegunaan, mendapatkan
- 646
- 92
- Ms. Santos Fritsch
Dia radio Ia adalah elemen logam yang dimiliki oleh kumpulan 2 jadual berkala, logam alkali, yang simbol kimianya adalah RA. Ia adalah ahli terakhir kumpulan ini, yang terletak di bawah barium, dan unsur -unsur radioaktif sebelumnya seperti thorium dan uranium; Walau bagaimanapun, jejari itu kira -kira sejuta kali lebih banyak radioaktif dan, oleh itu, lebih berbahaya daripada uranium itu sendiri.
Ini adalah elemen yang dikelilingi oleh cerita -cerita yang luar biasa dan malang, semuanya akibat kejahilan kesan negatifnya terhadap kesihatan. Kecerahan kebiruan garam dan penyelesaian berair yang menawan saintis Pierre dan Marie Curie, yang menemuinya pada tahun 1898 menganalisis radiasi yang tidak dapat diterangkan dan kuat dari sampel bijih pechblenda, yang mana kandungan uranium dan uranium mereka telah mengeluarkan kandungan uranium mereka dan polonium.
 Ilustrasi oleh Marie Curie, penemu radio
Ilustrasi oleh Marie Curie, penemu radio Uranium dan polonium yang dihapuskan, Curie dan menyimpulkan bahawa terdapat satu lagi elemen yang ada di Pechblenda, yang bertanggungjawab untuk radiasi yang kuat, yang dengan cerdik dapat mengukur. Unsur baru ini sangat mirip dengan Barium; Walau bagaimanapun, tidak seperti garis hijau spektrumnya, yang merupakan warna karmin.
Oleh itu, selepas memproses, membersihkan dan menganalisis tan pechblenda, mereka memperoleh 0.1 mg racl2. Pada masa itu, pada tahun 1902, mereka telah menentukan jisim atom radio, yang namanya berasal dari perkataan Latin 'jejari', yang bermaksud 'sinar'. Radio secara harfiah adalah elemen berseri.
Lapan kemudian, pada tahun 1910, Marie Curie bersama ahli kimia Perancis André Louis Debierne, berjaya mengasingkan radius dalam bentuk logam mereka oleh Electrolysis Racl2 menggunakan merkuri. Demam penyelidikan dilahirkan, yang kemudiannya menjadi sensasi komersial, kebudayaan dan perubatan yang membimbangkan.
[TOC]
Struktur
Radio adalah logam yang atomnya sangat besar. Akibatnya adalah bahawa kristal mereka sedikit padat (walaupun sedikit lebih daripada bario), dan mengamalkan struktur padu yang berpusat pada badan (BCC). Daripada struktur ini, tiada alotrop lain dilaporkan kepada suhu atau tekanan lain.
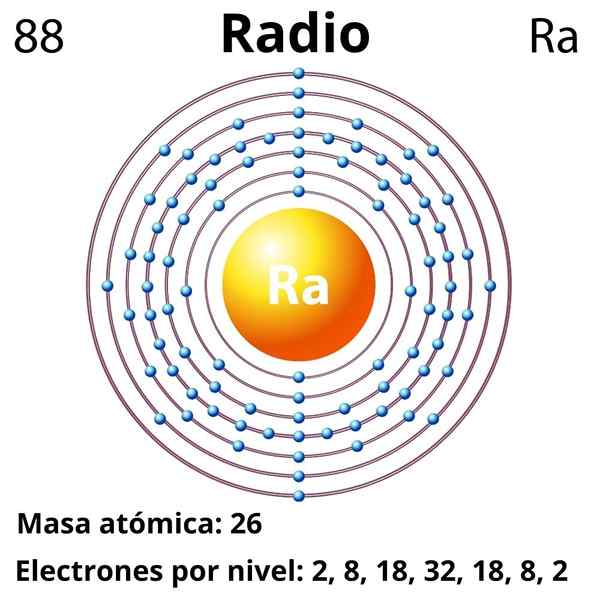
Konfigurasi Elektronik

Konfigurasi elektronik untuk radio adalah seperti berikut:
[RN] 7S2
Ia mengoksidakan dengan mudah untuk menjadi kation ra2+, yang isolektronik untuk gas radon mulia. Oleh itu, semua sebatian jejari mengandungi kation ra2+, mewujudkan interaksi ionik yang kebanyakannya; Walau bagaimanapun, dianggarkan bahawa mungkin, disebabkan oleh kesan relativistik, ia boleh membentuk pautan dengan watak kovalen yang luar biasa (RA-X).
Boleh melayani anda: kalium benzoat: struktur, sifat, mendapatkan, menggunakanSifat radio
 Sampel kompaun radio
Sampel kompaun radio Penampilan fizikal
Radio adalah logam putih perak, yang segera pewarna kuning dan gelap ketika bertindak balas dengan nitrogen dari udara untuk membentuk nitruro, RA3N2. Kerana begitu sukar untuk dimanipulasi, terdapat beberapa ciri fizikal jejari yang telah ditentukan secara langsung.
Nombor atom
88
Jisim molar
226.03 g/mol
Takat lebur
Sekitar 700 ºC. Besarnya ini belum dapat ditentukan dengan tepat.
Takat didih
Radio mendidih antara 1100 dan 1700 ºC. Margin ketidaktepatan yang hebat ini mencerminkan, sekali lagi, komplikasi memanipulasi logam yang tidak stabil.
Ketumpatan
5.5 g/cm3
Haba Fusion
8.5 kJ/mol
Haba pengewapan
113 kJ/mol
Keadaan pengoksidaan
Radio mempunyai satu keadaan pengoksidaan +2 tunggal.
Elektronegativiti
0.9. Nilai ini setia sesuai dengan watak elektropositif yang kuat dari jejari.
Tenaga pengionan
Pertama: 509.3 kJ/mol
Kedua: 979 kJ/mol
Radioaktiviti
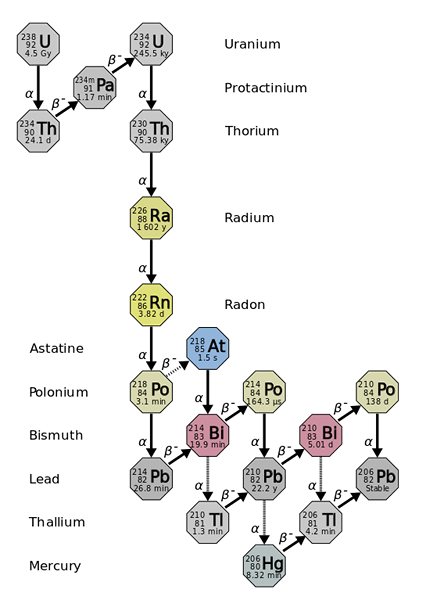 Radius berasal dari penurunan radioaktif unsur-unsur yang lebih berat dan tidak stabil, seperti isotop uranium-238. Sumber: Pengguna: Tosaka, CC oleh 3.0, melalui Wikimedia Commons
Radius berasal dari penurunan radioaktif unsur-unsur yang lebih berat dan tidak stabil, seperti isotop uranium-238. Sumber: Pengguna: Tosaka, CC oleh 3.0, melalui Wikimedia Commons Radius adalah kira -kira sejuta kali lebih banyak radioaktif daripada uranium. Ini disebabkan terutamanya oleh fakta bahawa isotop lain dihasilkan daripadanya, seperti 222RN (imej unggul), yang seterusnya mereput dengan memancarkan zarah α untuk berubah menjadi isotop 218PO. Oleh itu, sampel radio mengeluarkan sejumlah besar zarah α dan β-, serta sinar γ.
Contohnya, gram radio, menderita 3.7 · 1010 Disintegrasi sesaat, ukuran yang berfungsi untuk menentukan unit CI, yang dipanggil Curie. Tenaga ini cukup untuk memanaskan sampel 25 gram air 1 ° C per jam.
Sekiranya rantaian kerosakan diperhatikan, akan dilihat bahawa isotop awal, 238U, anda mempunyai t1/2 daripada 4.5 tahun giga (berbilion tahun); sebaliknya, 226RA mempunyai t1/2 1600 tahun, yang juga menghasilkan isotop dengan t1/2 hanya beberapa hari, minit dan saat.
Radioaktiviti radio dan sebatiannya adalah pengionan, jadi bahan pendarfluor, bahkan atom -atom sekitarnya, menyala pada waktu malam, dapat mencetuskan reaksi letupan. Harta ini dikenali sebagai radioluminescence.
Sebatian dan kereaktifan
Apabila garam atau sebatian radio dipanaskan dengan lebih ringan, mereka api api karmin. Pepejal seperti itu biasanya putih atau tidak berwarna, tetapi mereka dicelup kuning dan akhirnya menjadi gelap akibat radioaktiviti atom radio. Sekiranya mereka mempunyai kekotoran barium, mereka boleh menunjukkan nada merah jambu.
Boleh melayani anda: Reaksi penggantian bergandaKimia Radio sangat serupa dengan Bario, seolah-olah mereka adalah dua saudara yang tidak dapat dipisahkan, Ra-Ba. Kedua -duanya membentuk garam yang sama, tidak larut dalam air, dengan perbezaan bahawa radius sedikit lebih tidak larut. Sebagai contoh, radio sulfat, satin4, Ia lebih tidak larut daripada barium sulfat, Baso4; Malah, ia adalah sulfat yang paling tidak larut yang pernah diketahui: 2.1 mg daripadanya larut hanya dalam 1 liter air.
Sebaliknya, radio hidroksida, RA (OH)2, Ia adalah yang paling larut dan asas semua hidroksida rakan sebaya mereka.
Dalam penyelesaian, ra kation2+, Daripada berkelakuan seperti asid Lewis, mereka adalah asas, kerana saiznya yang besar menjadikannya mustahil untuk molekul.
Analogi kimia antara radio dan barium kembali ke logam ini sukar untuk dipisahkan, kerana garamnya coprecipitate dengan barium.
Penggunaan/Aplikasi Radio
Jam tangan bercahaya
 Jam tangan bercahaya dan fosforus sangat dikehendaki pada abad kesembilan belas, untuk daya tarikan visual mereka dan untuk mengandungi radio yang diiktiraf dalam lukisan mereka. Sumber: Senjata95, CC BY-SA 3.0, melalui Wikimedia Commons
Jam tangan bercahaya dan fosforus sangat dikehendaki pada abad kesembilan belas, untuk daya tarikan visual mereka dan untuk mengandungi radio yang diiktiraf dalam lukisan mereka. Sumber: Senjata95, CC BY-SA 3.0, melalui Wikimedia Commons Penggunaan radius yang paling popular dan kontroversi akan digunakan sebagai bahan tambahan untuk lukisan jam tangan. Atomnya dimasukkan ke dalam formulasi zink sulfida, ZnS, yang menyerap pelepasan radioaktif untuk melepaskan cahaya hijau dan fosforus. Cat itu digunakan pada tangan jam (imej unggul).
Masalah penggunaan ini adalah dalam pendedahan radioaktif yang berterusan yang mempengaruhi pengguna jam tangan ini; Atau lebih teruk, kepada pekerja yang melukis mereka di kilang -kilang.
Pada tahun 1924, beberapa pekerja yang bekerja dalam industri cat, yang kemudiannya dikenali sebagai gadis radio (radium gadis), mula mengalami kanser tulang, ubah bentuk rahang dan kehilangan gigi mereka, kerana mereka terpaksa menjilat hujung dari berus anda untuk menjadi dapat memohon cat radioaktif pada jam.
Ini, ditambah dengan kejahilan jejari, dan sedikit etika tidak mengenakan langkah -langkah perlindungan yang menjamin keselamatan pekerja, berakhir dengan skandal undang -undang yang merevolusikan undang -undang keselamatan pekerjaan.
Boleh melayani anda: menyewa halogenuros: sifat, mendapatkan, contohLukisan radio berhenti dihasilkan pada tahun 1960; Walaupun hari ini terdapat beberapa spesimen yang boleh ditagih yang memilikinya di permukaan mereka.
Radithor
 Botol raditor dipamerkan di Muzium Sains dan Sejarah Nuklear Negara, New Mexico. Sumber: Sam LaRussa dari Amerika Syarikat, CC By-SA 2.0, melalui Wikimedia Commons
Botol raditor dipamerkan di Muzium Sains dan Sejarah Nuklear Negara, New Mexico. Sumber: Sam LaRussa dari Amerika Syarikat, CC By-SA 2.0, melalui Wikimedia Commons Raditor adalah salah satu daripada banyak produk farmaseutikal dan kosmetik yang mengisytiharkan kecekapan radio untuk melawan seribu dan satu sakit. Ia mengandungi kuantiti radio mikrometrik, yang mana ia harus menyembuhkan semua penyakit pencernaan dan endokrin. Walau bagaimanapun, pada tahun 1932, selepas kematian Eden Byers, salah seorang pengguna yang paling kuat, raditor meninggalkan pasaran.
Radioterapi
Tidak semua kegunaan radio adalah sensasi, pseudoscientific dan tidak bertanggungjawab (atau penjenayah). Terdapat juga sangat bermanfaat untuk kesihatan, sekurang -kurangnya sehingga beberapa waktu. Garam Radio, RACL2 dan Rab2, Ia digunakan dalam rawatan kanser, khususnya kanser tulang.
Isotop 223Ra, apabila dikelirukan oleh ion kalsium dalam metabolisme, akhirnya memusnahkan sel -sel kanser yang terletak di tulang.
Walau bagaimanapun, banyak kegunaan terapeutik radius telah digantikan oleh isotop yang lebih selamat, ekonomi dan cekap, seperti 60Co dan 137Cs.
Memperoleh
Radio adalah salah satu elemen yang pengeluarannya terhad: hampir 100 gram setahun di seluruh dunia. Tan oren uranium, seperti bijih pechblenda (atau uraninite) diproses berikutan kaedah curie, yang terdiri daripada merawat sampel dengan natrium hidroksida, asid hidroklorik dan natrium karbonat, sehingga campuran radio dan barium sulfat, satin4-Baso4.
Campuran satin4-Baso4 Ia berubah menjadi klorida masing -masing, RACL2-Bacl2, memisahkan kation ra2+ oleh penghabluran pecahan dan akhirnya memurnikan teknik kromatografi ionik. Racl2 Ia dikurangkan dengan elektrolisis, atau mengurangkannya dengan aluminium logam hingga 1200 ºC.
Isotop
Semua isotop radio adalah radioaktif. Empat daripadanya wujud sebagai produk kerosakan radioaktif atom 232Th, 235U dan 238Atau.
Empat isotop ini adalah: 223Ra (t1/2= 11.4 hari), 224Ra (t1/2= 3.64 hari), 226Ra (t1/2= 1600 tahun) dan 228RA (5.75 tahun). Jelas, hampir semua atom radio terdiri daripada campuran isotop 226Ra dan 228Ra, kerana orang lain hancur dengan cepat.
Dia 226RA adalah yang paling stabil dari semua isotop radio, semua yang lain terlalu tidak stabil, dengan t1/2 Kurang dari dua jam.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Radium. Diperoleh dari: dalam.Wikipedia.org
- Editor enyclopaedia Britannica. (2020). Radium. Pulih dari: Britannica.com
- Radioaktiviti. (s.F.). Radium: Nukleus radioaktif yang menjadikan sejarah. Pulih dari: radioaktiviti.EU.com
- Cantrill, v. (2018). Realiti radium. CHEM NATURE 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Radium. Scientedirect. Diperoleh dari: Scientedirect.com
- « Faktor hakisan angin, jenis, akibat, contoh
- Geografi Semenanjung Italic, Negara, Flora, Fauna, Iklim »

