Reaksi endergonik

- 2817
- 347
- Mr. Tracy Parisian
 Tindak balas endary ialah tidak -spontan dan yang memerlukan banyak tenaga
Tindak balas endary ialah tidak -spontan dan yang memerlukan banyak tenaga Apakah reaksi endary?
A Reaksi endergonik Ia adalah yang tidak spontan, dan juga memerlukan bekalan tenaga yang tinggi. Dalam kimia, tenaga ini biasanya kalori. Yang paling terkenal di antara semua tindak balas endotermik adalah tindak balas endotermik, iaitu, yang menyerap haba.
Sebab mengapa tidak semua tindak balas spontan adalah kerana mereka mengambil tenaga, dan sistem yang dibentuk oleh spesies yang terlibat mengurangkan entropi mereka. Dengan kata lain, untuk tujuan kimia, mereka menjadi molekul lebih teratur.
Membina dinding bata adalah contoh reaksi endary. Bata sahaja tidak cukup padat untuk membentuk badan yang kukuh. Ini kerana tidak ada keuntungan tenaga yang menggalakkan kesatuannya (juga dapat dilihat dalam interaksi intermolecular yang rendah).
Untuk membina dinding yang anda perlukan simen dan buruh. Ini adalah tenaga, dan tindak balas bukan -spontan (dinding tidak akan dibina secara automatik) menjadi mungkin jika manfaat tenaga dirasakan (ekonomi, dalam hal dinding).
Sekiranya tidak ada manfaat, dinding akan runtuh pada sebarang gangguan, dan batu bata mereka tidak dapat bersatu. Begitu juga untuk banyak sebatian kimia, yang blok pembinaannya tidak dapat bergabung secara spontan.
Ciri -ciri tindak balas Endary
- Ia tidak spontan.
- Menyerap haba (atau jenis tenaga lain).
Sebabnya ialah produk mereka mempunyai lebih banyak tenaga daripada reagen yang terlibat dalam reaksi. Di atas boleh diwakili dengan persamaan berikut:
ΔG = gProduk-GReagen
Di mana ΔG adalah perubahan tenaga bebas gibbs. Sebagai gProduk lebih besar (kerana ia lebih bertenaga) daripada gReagen, Penolakan mestilah lebih besar daripada sifar (Δg> 0). Imej berikut meringkaskan yang baru dijelaskan:
Boleh melayani anda: natrium sulfat (na2SO4): struktur, sifat, kegunaan, memperoleh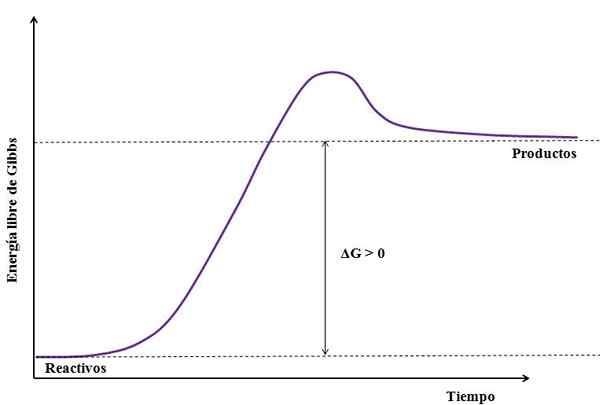 Angka reaksi endergonik. Sumber: Gabriel Bolívar
Angka reaksi endergonik. Sumber: Gabriel Bolívar Perhatikan perbezaan antara keadaan tenaga antara produk dan reagen (garis ungu). Oleh itu, reagen tidak berubah menjadi produk (a+b => c) jika tiada penyerapan haba terlebih dahulu.
Meningkatkan Tenaga Tenaga Percuma
Setiap tindak balas endergonik mempunyai peningkatan tenaga bebas sistem sistem. Sekiranya untuk tindak balas tertentu ia dipenuhi bahawa Δg> 0, maka ia tidak akan spontan dan memerlukan bekalan tenaga yang akan dijalankan.
Bagaimana untuk mengetahui secara matematik sama ada tindak balas adalah endegonik? Memohon persamaan berikut:
ΔG = ΔH-TΔS
Di mana ΔH adalah entalpi tindak balas, iaitu, jumlah tenaga yang dikeluarkan atau diserap, ΔS adalah perubahan entropi, dan T suhu. Faktor TΔS adalah kehilangan tenaga yang tidak dieksploitasi dalam pengembangan atau pesanan molekul dalam fasa (pepejal, cecair atau soda).
Oleh itu, ΔG adalah tenaga yang boleh digunakan oleh sistem untuk melaksanakan pekerjaan. Oleh kerana ΔG mempunyai tanda positif untuk tindak balas, tenaga atau kerja (reagen) endary mesti digunakan untuk mendapatkan produk.
Oleh itu, mengetahui nilai ΔH (positif, untuk tindak balas endotermik, dan negatif, untuk tindak balas eksotermik), dan TδS, anda boleh tahu jika reaksi adalah akhir -gononik.
Ini bermaksud, walaupun tindak balas adalah endotermik, Tidak Semestinya endogonik.
Kiub ais
Sebagai contoh, kiub ais cair dalam haba menyerap air cair, yang membantu memisahkan molekulnya; Walau bagaimanapun, prosesnya adalah spontan dan, oleh itu, ia bukan reaksi akhir.
Sekiranya ais ditubuhkan pada suhu yang jauh di bawah -100 ° C, istilah TΔS persamaan tenaga bebas menjadi kecil berbanding ΔH (kerana T berkurangan), dan sebagai hasilnya, ΔG akan mempunyai nilai positif.
Boleh melayani anda: asid karboksilikDengan kata lain: Melelehkan ais di bawah -100 ° C adalah proses endegonik, dan ia tidak spontan. Kes yang sama adalah untuk membekukan air sekitar 50 ° C, yang tidak berlaku secara spontan.
Pautan produk mereka lebih lemah
Satu lagi ciri penting, juga berkaitan dengan ΔG, adalah tenaga pautan baru. Pautan produk yang terbentuk lebih lemah daripada reagen.
Walau bagaimanapun, penurunan daya pautan itu dikompensasi dengan keuntungan besar -besaran, yang ditunjukkan dalam sifat fizikal.
Di sini perbandingan dengan dinding bata mula kehilangan makna. Menurut perkara di atas, bar di dalam batu bata mestilah lebih kuat daripada yang di antara mereka dan simen. Walau bagaimanapun, dinding secara keseluruhan lebih tegar dan tahan mempunyai jisim yang lebih besar.
Ia ditambah dengan tindak balas exergonik
Sekiranya reaksi yang membayangkan tidak spontan, bagaimana ia berlaku di alam semula jadi? Jawapannya disebabkan oleh gandingan dengan tindak balas lain yang agak spontan (exergonic) dan entah bagaimana mempromosikan perkembangan mereka.
Sebagai contoh, persamaan kimia berikut mewakili perkara ini:
A + b => c (reaksi endergonik)
C + d => e (reaksi exergonik)
Reaksi pertama tidak spontan, jadi secara semulajadi ia tidak dapat berlaku. Walau bagaimanapun, pengeluaran c membolehkan tindak balas kedua berlaku, menyebabkan dan.
Menambah tenaga bebas Gibbs untuk kedua -dua reaksi, ΔG1 dan ΔG2, Hasilnya kurang daripada sifar (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Ia dapat melayani anda: hidrorSekiranya C tidak bertindak balas dengan D, saya tidak boleh membentuknya, kerana tidak mempunyai pampasan tenaga (seperti hal wang dengan dinding bata). Kemudian dikatakan bahawa C dan D "Jalan" kepada A dan B untuk bertindak balas, walaupun menjadi reaksi endegonik.
Contoh tindak balas endergonik
Fotosintesis
Tumbuhan menggunakan tenaga solar untuk menghasilkan karbohidrat dan oksigen dari karbon dioksida dan air. CO₂ dan O2, Molekul kecil dengan pautan yang kuat, bentuk gula, struktur tarry, yang lebih berat, pepejal, dan mencairkan pada suhu sekitar 186º C.
Perhatikan bahawa pautan C-C, C-H dan C-O lebih lemah daripada O = C = O dan O = O. Dan dari unit gula, tumbuhan boleh mensintesis polysaccharides, seperti selulosa.
Sintesis biomolekul dan makromolekul
Reaksi endermanik adalah sebahagian daripada proses anabolik. Seperti karbohidrat, biomolekul lain, seperti protein, dan lipid, memerlukan mekanisme kompleks yang tanpa mereka, dan gandingan dengan reaksi hidrolisis ATP, tidak mungkin ada.
Pembentukan berlian dan sebatian berat mentah
Berlian memerlukan tekanan dan suhu yang besar, supaya komponen mereka dapat padat dalam pepejal kristal.
Walau bagaimanapun, beberapa kristalisasi adalah spontan, walaupun mereka lulus pada kelajuan yang sangat perlahan (spontan tidak berkaitan dengan kinetik reaksi).
Akhirnya, minyak mentah sahaja mewakili produk tindak balas endergonik, terutamanya hidrokarbon berat atau makromolekul yang disebut asfalten.
Struktur mereka sangat rumit, dan sintesis mereka memerlukan banyak masa (berjuta -juta tahun), tindakan panas dan bakteria.
Contoh lain
- Pernafasan selular tumbuhan.
- Pengangkutan oksigen di aliran darah.
- Penyebaran ion melalui membran sel.
- Penguncupan otot.
- Sintesis protein sel.
Rujukan
- Reaksi endermanic dan exeronik. Pulih dari Quimitube.com
- Tenaga bebas. Pulih dari ES.Khanacademy.org
- Definisi reaksi endergonik. Diperolehi daripada Biologi.jaring

