Tindak balas eksotermik dan endotermik
- 2332
- 168
- Horace Gulgowski
 Pembakaran adalah contoh tindak balas eksotermik, kerana ia melepaskan haba. Bagi bahagiannya, ais cair melalui tindak balas endotermik, kerana ia memerlukan tenaga terma
Pembakaran adalah contoh tindak balas eksotermik, kerana ia melepaskan haba. Bagi bahagiannya, ais cair melalui tindak balas endotermik, kerana ia memerlukan tenaga terma The tindak balas eksotermik dan endotermik Mereka berbeza dengan hakikat bahawa tenaga terma yang pertama, sementara yang terakhir menyerapnya, menurut perubahan haba yang berlaku semasa tindak balas kimia.
Begitu juga, jenis tenaga lain boleh terlibat dalam tindak balas kimia, kerana kadang -kadang semasa tindak balas, tenaga ringan, tenaga bunyi dan juga elektrik dihasilkan.
Untuk mengambil kira bukan sahaja haba, tetapi jenis tenaga lain, tindak balas kimia diklasifikasikan sebagai exergonic dan Endermanik. Reaksi exergonik mengeluarkan tenaga apabila dihasilkan, sementara endegonik menyerapnya.
Dalam kes ini, tindak balas eksotermik juga merupakan tindak balas exergonik, kerana ia melepaskan haba. Salah satu contoh yang paling biasa adalah pembakaran. Setiap kali sekeping kayu dibakar, tenaga kalori dan cerah dilepaskan.
Sebaliknya, salah satu tindak balas kimia endergiving yang paling terkenal berlaku apabila mencairkan kiub ais, kerana ais menyerap tenaga haba alam sekitar untuk berubah menjadi air cair.
Reaksi eksotermik boleh berlaku secara spontan, walaupun kadang -kadang anda perlu melakukan kerja untuk bermula. Walau bagaimanapun, untuk tindak balas endotermik berlaku, selalu perlu bagi alam sekitar untuk melakukan pekerjaan di sistem.
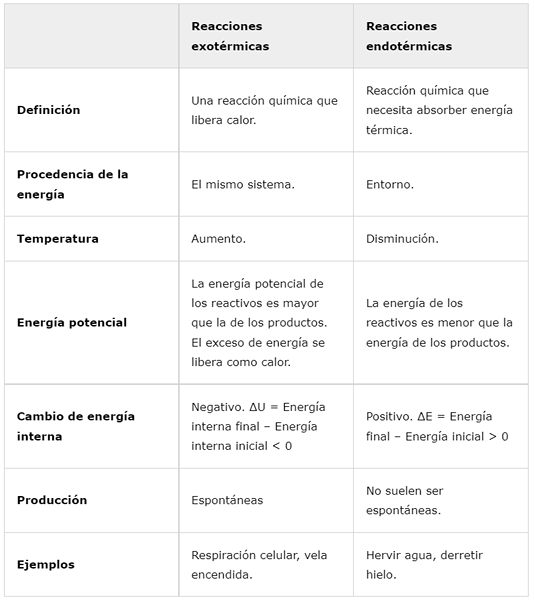
Reaksi eksotermik | Reaksi endotermik | |
Definisi | Tindak balas kimia yang melepaskan haba. | Tindak balas kimia yang perlu menyerap tenaga terma. |
Asal tenaga | Sistem yang sama. | Sekitar. |
Suhu | Meningkat. | Penurunan. |
Tenaga keupayaan | Tenaga berpotensi reagen lebih besar daripada produk. Tenaga berlebihan dilepaskan sebagai haba. | Tenaga reagen kurang daripada tenaga produk. |
Perubahan tenaga dalaman | Negatif. ΔU = Tenaga Dalaman Akhir - Tenaga Dalaman Awal < 0 | Positif. ΔE = Tenaga Akhir - Tenaga Awal> 0 |
Pengeluaran | Spontan | Mereka biasanya tidak spontan. |
Contoh | Pernafasan selular, membakar lilin. | Rebus air, cairkan ais. |
Reaksi eksotermik
Definisi
Jenis tindak balas kimia yang melepaskan haba apabila ia dijalankan.
Ia boleh melayani anda: Cyclohexen: struktur, sifat, sintesis dan kegunaanAsal tenaga
Sistem yang sama memberikan tenaga supaya reaksi berlaku.
Suhu
Selepas reaksi ada a meningkat suhu.
Tenaga keupayaan
Apabila tindak balas kimia berlaku di antara reagen, pautan dipecahkan di antara mereka dan yang lain dibentuk untuk menghasilkan molekul baru. Tetapi tidak semua pautan menyatukan atom dan molekul dengan daya yang sama, oleh itu, tenaga untuk memecahkan atau membuat setiap pautan adalah berbeza.
Semasa setiap tindak balas mereka memecahkan dan menghasilkan bilangan pautan yang berlainan, jadi tenaga berbeza. Dalam tindak balas eksotermik, potensi tenaga reagen lebih tua daripada produk, dan sejak tenaga dipelihara, kelebihannya dilepaskan sebagai haba.
Perubahan tenaga dalaman
Tenaga dalaman berkaitan dengan keupayaan sistem untuk melaksanakan kerja, dan termasuk tenaga dan tenaga kinetik yang berpotensi. Tenaga mutlak sistem tidak ditentukan, tetapi variasinya, dipanggil ΔU.
Mengikut apa yang dikatakan di bahagian sebelumnya, perubahan tenaga dalaman ΔU adalah negatif.
Δu = tenaga dalaman akhir - tenaga dalaman awal < 0
Pengeluaran
Sebilangan besar tindak balas eksotermik adalah spontan, iaitu, mereka berlaku untuk diri mereka sendiri, tanpa perlu menambah tenaga luaran, sehingga reagen habis.
Contoh
Biasanya, tindak balas pengoksidaan dan yang membawa kepada pembentukan kompaun biasanya reaksi eksotermik:
1. Larut detergen di dalam air
Semasa membubarkan debu pakaian di sedikit air sejuk, dia berasa hangat ketika menyentuhnya.
2. Pernafasan selular
Pada haiwan dan tumbuh -tumbuhan, proses pernafasan sel dilaksanakan sebagai sebahagian daripada kitaran karbon. Pernafasan menggunakan glukosa dan oksigen untuk mengembalikan karbon dioksida, air dan tenaga, menurut reaksi:
Boleh melayani anda: Titanium Oxide (IV): Struktur, Hartanah, KegunaanC6H12Sama ada6 + 6th2 → 6co2 + H2O + Tenaga (ATP)
3. Lilin yang terbakar
Di samping cahaya, lilin terbakar mengeluarkan haba dan bahan lain:
Oksigen oksigen → air + karbon dioksida + cahaya dan panas
4. Kumbang pengeboman
Serangga ini mempertahankan dirinya dengan menaburkan aerosol mengenai pemangsa. Kumbang menyimpan cecair dan enzim di ruang berasingan, yang terletak di perutnya.
Apabila terancam, ia mengeluarkan cecair ke arah petak enzim dan tindak balas kimia yang menghasilkan stim dan haba dihasilkan, bertindak sebagai penghalau untuk pemangsa yang mungkin.
5. Bulu keluli dan cuka
Logam seperti besi perlahan -lahan teroksida apabila bertindak balas dengan alam sekitar, tetapi jika cuka ditambah kepada bulu keluli kecil, diperhatikan bahawa pengoksidaan jauh lebih cepat dan pada masa yang sama menghasilkan haba.
Reaksi endotermik
Definisi
Reaksi di mana reagen perlu menyerap tenaga terma supaya produk diperolehi.
Asal tenaga
Tenaga yang diperlukan untuk reaksi dilakukan hasil dari persekitaran.
Suhu
Reaksi endotermik memerlukan a penurunan suhu.
Tenaga keupayaan
Tidak seperti apa yang berlaku dengan tindak balas eksotermik, tenaga reagen Ia kurang bahawa tenaga produk.
Perubahan tenaga dalaman
Dalam tindak balas endotermik, perubahan tenaga dalaman ΔE adalah positif.
ΔE = Tenaga Akhir - Tenaga Awal> 0
Oleh itu, tenaga akhir lebih besar daripada permulaan.
Pengeluaran
Reaksi endothermal memerlukan kerja pada sistem yang dilakukan, jadi mereka biasanya tidak spontan.
Walau bagaimanapun, terdapat beberapa tindak balas endotermik, seperti pencairan ais dan penyejatan cecair tertentu, yang spontan pada suhu bilik.
Disimpulkan kemudian bahawa suhu persekitaran adalah faktor penentu dalam spontan reaksi kimia.
Ia boleh melayani anda: Petunjuk Kimia: Apa yang Mereka, Jenis, ContohContoh
Banyak tindak balas yang melibatkan pembubaran garam dan, secara umum, penguraian bahan, biasanya endotermik. Dengan cara yang sama, laluan ais ke air cair, dan air cair stim, iaitu transformasi keadaan, juga reaksi endotermik.
1. Fotosintesis
Tumbuhan menjalankan tindak balas kimia dengan kehadiran cahaya matahari, di mana mereka menukar karbon dioksida dan air menjadi glukosa dan oksigen. Chlorophyll adalah molekul utama dalam proses ini, yang reaksi kimianya adalah:
Cahaya + 6co2 + H2O → c6H12Sama ada6 + 6th2
Seperti yang dapat dilihat, ia adalah tindak balas terbalik bernafas. Untuk menghasilkan satu kilogram glukosa, 15 mega joules tenaga solar diperlukan.
2. Rebus air dan masak
Reaksi yang sangat biasa, yang memerlukan tenaga untuk diteruskan, adalah air mendidih:
H2O (cecair) + tenaga → h2O (stim)
Makanan biasanya memerlukan air untuk memasak, dan dengan cara yang sama air yang mereka ada mesti menguap untuk memasaknya, yang melibatkan perubahan keadaan.
3. Untuk mencairkan ais
Begitu juga, adalah perkara biasa untuk ais mencairkan pada suhu bilik, jika ini lebih besar daripada 0 ° C:
H2O (pepejal) + tenaga → h2O (cecair)
Oleh itu, minuman itu sejuk ketika menambah ais, kerana ia menyerap tenaga yang diperlukan untuk mengubah keadaan dari cecair.
4. Beg sejuk
Mereka digunakan untuk merawat lebam dan pukulan. Mengandungi air dan sampul surat dengan ammonium klorida. Semasa mengetuk beg, sampul surat rosak dan reaksi ammonium klorida dengan air, yang endothermic, menyejukkan beg dan melegakan kesakitan.
5. Pengeluaran ozon
Sinaran ultraviolet dari matahari mengubah oksigen menjadi ozon, melepaskan haba dalam proses.
Ke -32 (gas) + cahaya ultraviolet → ke -23 (Gas)
Rujukan
- Byju's. Perbezaan antara tindak balas edotermik dan eksotermik. Pulih dari Byjus.com
- Chang, R. (2013). Kimia. 11va. Edisi. Pendidikan McGraw Hill.
- Grelane. Reaksi eksotermik terhadap perkara panas. Pulih dari: Grelane.com.
- Hein, m. (2014). Asas Kimia Kolej. Wiley.
- Helmestine, a. Memahami tindak balas endotermik dan eksotermik. Pulih dari: Thoughtco.com

