Peraturan tenggelam atau kepelbagaian maksimum

- 2754
- 6
- Anthony Breitenberg
Kami menerangkan apa peraturan atau prinsip kepelbagaian maksimum, langkah -langkah untuk menerapkannya dan memberi beberapa contoh
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Apakah peraturan sink?
The Peraturan tenggelam, Juga dipanggil prinsip kepelbagaian maksimum putaran, ia adalah peraturan empirikal yang digunakan untuk menulis konfigurasi elektronik mutlak unsur -unsur kimia ketika mereka berada dalam keadaan asas mereka. Iaitu, ia adalah peraturan yang membantu meramalkan bagaimana elektron diedarkan dalam orbital atom atom yang santai atau pada tahap terendah tenaga.
Peraturan Tenggelam mengatakan:
"... Dalam atom yang berada dalam keadaan asasnya, elektron dari tahap tenaga yang sama akan diedarkan sedemikian rupa sehingga terdapat sebanyak mungkin duri selari".
Peraturan ini sepadan dengan salah satu prinsip asas mekanik kuantum dan teori atom semasa. Sangat berguna untuk memahami beberapa sifat unsur -unsur yang berbeza, terutama sifat magnet mereka. Ini kerana atom tertarik atau ditolak oleh magnet kerana mereka telah hilang elektron dalam struktur mereka.
Dari mana peraturan tenggelam atau maksimum maksimum berasal?
Spektrum atom
Prinsip ini mula -mula mengutuk Fizik Jerman Friedrich Hund pada tahun 1927. Tenggelam yang dikaji spektrum penyerapan atom, yang membolehkan secara eksperimen mengukur tenaga yang diserap elektron apabila terdedah kepada sinaran elektromagnet dari panjang gelombang yang mencukupi. Pemerhatian eksperimen hanya dapat dijelaskan jika atom memiliki sebanyak mungkin elektron dengan putaran yang sama.
Elektron yang hilang
Sebagai tambahan kepada spektrum atom, terdapat pemerhatian eksperimen lain yang mengesahkan konfigurasi elektronik yang diramalkan dengan menggunakan peraturan hund. Yang paling penting terdiri daripada langkah -langkah eksperimen sifat -sifat magnet atom yang membolehkan menentukan berapa banyak elektron yang hilang mempunyai atom.
Ia boleh melayani anda: elektrolisis airElektron yang hilang adalah mereka yang bersendirian dalam orbital, tanpa pasangan berputar bertentangan masing -masing.
Langkah untuk menerapkan peraturan sink
Peraturan sink terpakai apabila kita menulis konfigurasi elektronik atom dalam keadaan asasnya. Ini bermakna ia adalah peraturan pelengkap peraturan lain, seperti prinsip Aufbau atau prinsip pembinaan (juga dipanggil peraturan hujan) dan prinsip pengecualian Pauli.
Hanya berlaku untuk kes -kes yang kita mahukan.
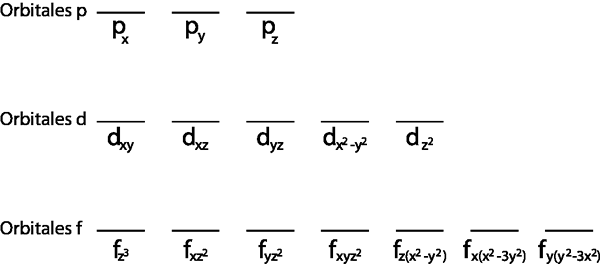
Di samping itu, hanya masuk akal untuk menerapkannya untuk lapisan Valencia, iaitu tahap tenaga yang tidak lengkap (ia tidak mempunyai semua elektron yang sesuai di dalamnya). Jika tidak, semua elektron akan dipasangkan untuk mematuhi prinsip pengecualian Pauli.
Permohonan peraturan ini terdiri daripada langkah -langkah berikut:
- Langkah 1: Lukis garis mendatar atau segi empat tepat kecil untuk setiap orbital sub -level.
- Langkah 2: Letakkan elektron pertama di orbital pertama dengan putaran anda menunjuk ke atas.
- Langkah 3: Letakkan elektron berikut di orbital seterusnya, juga menunjuk.
- Langkah 4: Teruskan seperti ini sehingga elektron berakhir atau tidak ada lagi orbital kosong.
- Langkah 5: Jika ketika meletakkan elektron di setiap orbit, masih ada elektron yang akan diedarkan, ulangi langkah 2 hingga 4 tetapi meletakkan elektron dengan spin mereka menunjuk ke bawah.
Untuk memahami bagaimana langkah -langkah ini berlaku, mari kita menganalisis beberapa contoh.
Contoh 1: Konfigurasi Elektronik Nitrogen
Nitrogen adalah unsur nombor 7, jadi ia mempunyai sejumlah 7 elektron yang berputar di sekitar nukleus. Elektron ini diedarkan seperti berikut, mengikuti peraturan hujan:
Boleh melayani anda: acetanylide (c8h9no)1s2 2s2 2 p3
Seperti yang dapat kita lihat, lapisan valensi nitrogen sepadan dengan tahap 2 tenaga (dipanggil lapisan l) di mana 8 elektron sesuai. Walau bagaimanapun, nitrogen hanya mempunyai 5 elektron Valencia.
Di orbital s Hanya 2 elektron yang sesuai, jadi orbital 2s sepenuhnya penuh dan tidak masuk akal untuk menerapkan peraturan sink untuk orbital ini.
Sebaliknya, sub -level 2p, yang mengandungi 3 orbital, tidak penuh. Tetapi bagaimana 3 elektron ini diedarkan dalam tiga orbital tersebut? Mereka diedarkan berikutan langkah -langkah peraturan sinki, yang dibentangkan di bawah:
Langkah 1: Lukis garis mendatar atau segi empat tepat kecil untuk setiap orbital sub -level.
Kerana ia adalah sub -level 2p, terdapat tiga orbital yang 2px, 2 pdan dan 2pz. Oleh itu, kita mesti menarik tiga jalur mendatar atau tiga kotak atau segi empat tepat:
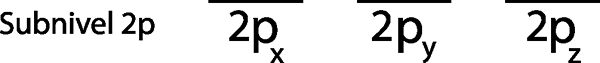
Setiap jalur atau kotak ini mewakili orbital, seperti yang ditunjukkan oleh nama yang telah turun masing -masing.
Langkah 2: Letakkan elektron pertama di orbital pertama dengan putaran anda menunjuk ke atas.
Kami meletakkan elektron pertama di orbital 2px Oleh kerana ini adalah orbital pertama dalam senarai.
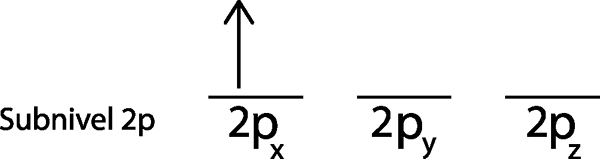
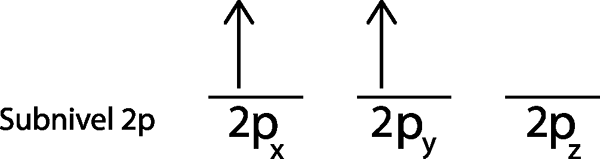
Langkah 3: Letakkan elektron berikut di orbital seterusnya, juga menunjuk.
Elektron kedua terletak di orbital 2pdan
Langkah 4: Teruskan seperti ini sehingga elektron berakhir atau tidak ada lagi orbital kosong.
Dalam kes kita, kita hanya perlu mengedarkan 3 elektron, jadi kita hanya perlu meletakkan elektron terakhir di orbital dan voila terakhir:
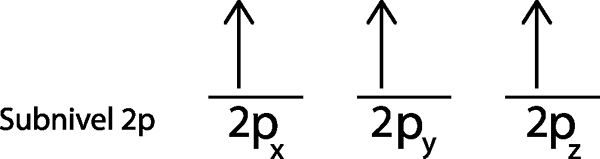
Seperti yang dapat dilihat, prinsip kepelbagaian maksimum atau peraturan tenggelam meramalkan bahawa nitrogen atom mesti mempunyai 3 elektron yang hilang.
Boleh melayani anda: nitrogen oksida (NOx)Dalam kes ini, tidak perlu memohon langkah 5, kerana selepas langkah 4 kita ditinggalkan tanpa elektron untuk mengedarkan.
Contoh 2: Konfigurasi Elektronik Besi
Besi adalah elemen 26 dan konfigurasi elektroniknya ialah:
1s2 2s2 2 p6 3s2 3p6 3d6 4s2
Dalam kes ini, kita dapat perhatikan bahawa orbital dengan tahap tenaga tertinggi adalah 4s, tetapi kerana ia adalah logam peralihan, besi mempunyai sebahagian besar orbit penuh d. Ini adalah orbital yang elektronnya kita akan mengedarkan berikutan peraturan hund.
Langkah 1: Lukis garis mendatar atau segi empat tepat kecil untuk setiap orbital sub -level.
Kami akan mengisi sub -level 3D yang mengandungi 5 orbital:
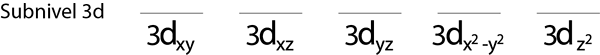
Langkah 2: Letakkan elektron pertama di orbital pertama dengan putaran anda menunjuk ke atas.
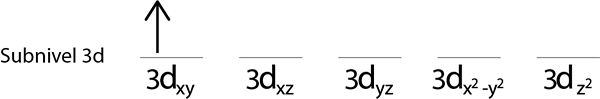
Langkah 3: Letakkan elektron berikut dalam orbital berikut, juga menunjuk.
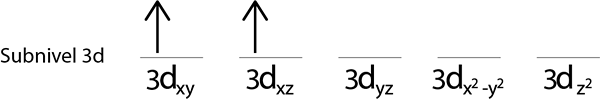
Langkah 4: Teruskan seperti ini sehingga elektron berakhir atau tidak ada lagi orbital kosong.
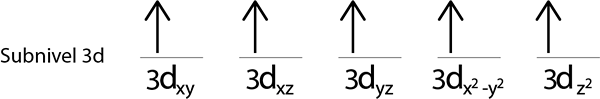
Langkah 5: Jika ketika meletakkan elektron di setiap orbit, masih ada elektron yang akan diedarkan, ulangi langkah 2 hingga 4 tetapi meletakkan elektron dengan spin mereka menunjuk ke bawah.
Seperti yang kita masih mempunyai elektron untuk diedarkan selepas meletakkan elektron di setiap orbit 3d, yang terakhir dari 6 elektron diletakkan dengan putaran bertentangan di orbital pertama.
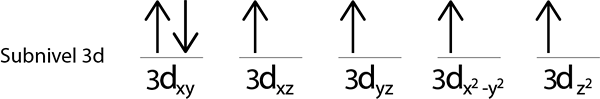
Ini adalah konfigurasi mutlak atom besi dalam keadaan asasnya. Sama, besi mempunyai 4 elektron yang hilang dengan duri selari.
Rujukan
- Tanpa menjawab soalan mengenai kepelbagaian maksimum atau peraturan tenggelam: Apa yang perlu dilakukan (2020). Diambil dari Physis andquimica.com.
- Tenggelam - Kimia (2021). Diambil dari CostProject.org.
- Kepelbagaian maksimum sind (2020). Diambil dari Principiode.com.
- Peraturan sink | Panduan Kimia (2012). Diambil dari kimia.Laguia2000.com.

