Rubidio Historia, sifat, struktur, mendapatkan, menggunakan

- 3362
- 311
- Julius Dibbert
Dia Rubidium Ia adalah elemen logam yang dimiliki oleh kumpulan 1 dari jadual berkala: logam alkali, yang diwakili oleh simbol kimia RB. Namanya terdengar seperti Rubí, dan kerana ketika spektrum pelepasannya ditemui, dia menunjukkan garis ciri merah yang kuat.
Ia adalah salah satu logam paling reaktif yang wujud. Ini adalah yang pertama dari logam alkali yang, walaupun sedikit padat, tenggelam ke dalam air. Ia juga bertindak balas dengan dia lebih letih berbanding dengan litium, natrium dan kalium. Terdapat eksperimen di mana ampul disimpan (imej yang lebih rendah) jatuh dan meletup di tab mandi.
 Ampoule dengan gram rubidium yang disimpan di bawah suasana lengai. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Ampoule dengan gram rubidium yang disimpan di bawah suasana lengai. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Rubidio dibezakan dengan menjadi logam yang lebih mahal daripada emas yang sama; Tidak banyak untuk kekurangannya, tetapi untuk pengedaran mineralogi yang luas di kerak bumi dan kesukaran yang timbul ketika mengasingkannya kalium dan berhenti sebatian.
Ia menunjukkan kecenderungan yang jelas untuk mengaitkan dengan kalium dalam mineralnya, mencari sebagai kekotoran. Bukan sahaja dalam bahan geokimia membentuk duo dengan kalium, tetapi juga dalam bidang biokimia.
Organisma "membingungkan"+ Bagi mereka yang RB+; Walau bagaimanapun, Rubidio bukanlah elemen penting setakat ini, kerana tidak diketahui apa peranan yang dimainkannya dalam metabolisme. Walaupun begitu, suplemen rubidium telah digunakan untuk mengurangkan keadaan perubatan tertentu seperti kemurungan dan epilepsi. Sebaliknya, kedua -dua ion membakar api ungu di panas yang lebih ringan.
Oleh kerana kosnya yang tinggi, aplikasinya tidak berasaskan terlalu banyak dalam sintesis pemangkin atau bahan, tetapi sebagai komponen untuk pelbagai peranti dengan pangkalan teoritis fizikal. Salah satunya ialah jam atom, sel solar dan magnetometer. Itulah sebabnya kadang -kadang rubidium diambil sebagai logam yang dipandang rendah atau sedikit dipelajari.
[TOC]
Sejarah
Rubidio ditemui pada tahun 1861 oleh ahli kimia Jerman Robert Bunsen dan Gustav Kirchhoff, menggunakan spektroskopi. Untuk melakukan ini, mereka menggunakan Bunsen Lighter dan Spectroscope, yang dicipta dua tahun sebelum, sebagai tambahan kepada teknik pemendakan analisis. Objek kajiannya ialah Mineral Lepidolit, yang menunjukkan koleksi Saxony, Jerman.
Mereka bermula dari 150 kg mineral lepidolit, yang mereka dirawat dengan asid chloroplatinic, h2PTCL6, Untuk mendakan hexacloroplatinate kalium, k2PTCL6. Walau bagaimanapun, ketika mereka mempelajari spektrum mereka dengan membakarnya di Bunsen Lighter, mereka menyedari bahawa mereka mempamerkan garis pelepasan yang tidak bertepatan dengan itu dengan unsur lain.
Spektrum pelepasan elemen baru ini dicirikan dengan mempunyai dua garis yang ditentukan di rantau merah. Itulah sebabnya dia dibaptis dengan nama 'Rubidus' yang bermaksud 'Dark Red'. Kemudian, Bunsen dan Kirchhoff berjaya memisahkan RB2PTCL6 daripada k2PTCL6 oleh penghabluran fraksionasi; Akhirnya mengurangkannya ke garam klorida anda menggunakan hidrogen.
Dikenal pasti dan mengasingkan garam elemen Rubidio yang baru, ahli kimia Jerman hanya perlu mengurangkannya ke keadaan logam mereka. Untuk mencapai matlamat ini, mereka mencuba dengan dua cara: memohon elektrolisis ke rubidium klorida, atau memanaskan garam mudah untuk dikurangkan, seperti tartrato. Oleh itu, rubidio logam dilahirkan.
Sifat fizikal dan kimia
Penampilan
Logam kelabu perak. Ia sangat lembut sehingga kelihatan seperti mentega. Ia biasanya dibungkus di dalam ampul kaca, di mana suasana lengai mendominasi yang melindunginya daripada bertindak balas dengan udara.
Nombor atom (z)
37
Jisim molar
85,4678 g/mol
Takat lebur
39 ºC
Takat didih
688 ºC
Ketumpatan
Pada suhu bilik: 1,532 g/cm3
Di titik lebur: 1.46 g/cm3
Ketumpatan rubidium lebih tinggi daripada air, jadi ia akan tenggelam sambil bertindak balas dengan ganas dengannya.
Haba Fusion
2.19 kJ/mol
Haba pengewapan
69 kJ/mol
Elektronegativiti
0.82 pada skala Pauling
Affinity Elektronik
46.9 kJ/mol
Tenaga pengionan
-Pertama: 403 kJ/mol (RB+ gas)
-Kedua: 2632.1 kJ/mol (RB2+ gas)
-Ketiga: 3859.4 kJ/mol (RB3+ gas)
Radio atom
248 petang (empirikal)
Kekonduksian terma
58.2 w/(m · k)
Resistiviti elektrik
128 nΩ · m pada 20 ° C
Kekerasan mohs
0.3. Oleh itu, walaupun talc lebih sukar daripada rubidium logam.
Reaktiviti
 Latihan api untuk rubidium. Semasa dia bertindak balas, dia mengucapkan selamat tinggal kepada api ungu. Sumber: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Latihan api untuk rubidium. Semasa dia bertindak balas, dia mengucapkan selamat tinggal kepada api ungu. Sumber: Didaktische.Medien [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Rubidio adalah salah satu logam alkali yang paling reaktif, selepas Cesio dan Francio. Dia hampir tidak terdedah kepada udara mula terbakar, dan jika dia bersungguh -sungguh, dia menembak percikan bercahaya. Sekiranya dia dipanaskan, dia juga memancarkan api ungu (imej unggul), yang merupakan ujian positif untuk ion RB+.
Boleh melayani anda: Ididio 192Bertindak balas dengan oksigen untuk membentuk campuran peroksida (RB2Sama ada2) dan superoxida (RBO2). Walaupun ia tidak bertindak balas dengan asid dan asas, ia melanggarnya dengan air, menghasilkan rubidium dan hidrogen hidroksida hidrogen:
RB (s) + h2Atau (l) => rboh (ac) + h2(g)
Bertindak balas dengan hidrogen untuk membentuk hidrida yang sepadan:
RB (s) + h2(g) => 2rbh (s)
Dan juga dengan halogen dan sulfur meletup:
2RB (s) + Cl2(g) => rbcl (s)
2RB (s) + s (l) => rb2H.H)
Walaupun rubidium tidak dianggap sebagai elemen toksik, ia berpotensi berbahaya dan mewakili risiko kebakaran ketika bersentuhan dengan air dan oksigen.
Struktur dan konfigurasi elektronik
Atom Rubidio diatur sedemikian rupa sehingga mereka menubuhkan struktur padu kristal yang berpusat di dalam badan (BCC). Struktur ini adalah ciri untuk logam alkali, yang ringan dan cenderung terapung di atas air; Kecuali Rubidium Down (Cesio dan Francio).
Dalam kristal Rubidio BCC, atom RB mereka berinteraksi antara satu sama lain terima kasih kepada pautan logam. Ini ditadbir oleh "laut elektron" lapisan valensinya, dari orbital 5s mengikut konfigurasi elektroniknya:
[KR] 5s1
Semua orbital 5s dengan satu -satunya elektron mereka bertindih dalam semua dimensi kristal logam rubidio. Walau bagaimanapun, interaksi ini lemah, kerana sebagai kumpulan logam alkali turun, orbital menjadi lebih meresap dan, oleh itu, pautan logam melemahkan.
Itulah sebabnya titik lebur rubidium adalah 39 ºC. Juga, ikatan logam lemahnya menerangkan kelembutan pepejalnya; sangat lembut sehingga nampaknya mentega perak.
Tidak ada maklumat bibliografi yang mencukupi mengenai tingkah laku kristal mereka di bawah tekanan tinggi; Sekiranya terdapat fasa paling padat dengan sifat unik seperti natrium.
Nombor pengoksidaan
Konfigurasi elektroniknya sekali menunjukkan bahawa rubidium sangat cenderung kehilangan elektron sahaja untuk menjadi isolektronik kepada gas kripton gas mulia. Apabila ia berlaku, kation monovalen dibentuk RB+. Dikatakan bahawa dalam sebatiannya ia mempunyai nombor pengoksidaan +1 apabila kewujudan kation ini diandaikan.
Oleh kerana trend rubidium untuk mengoksidakan, andaian bahawa terdapat ion rb+ Dalam sebatiannya berjaya, yang seterusnya menunjukkan sifat ionik sebatian ini.
Dalam hampir semua sebatian rubidium ini mempamerkan bilangan pengoksidaan +1. Contohnya adalah seperti berikut:
-Rubid Chloride, RBCL (RB+Cl-)
-Rubidio Hydroxide, RBOH (RB+ Oh-)
-Rubidio Carbonate, RB2Co3 (RB2+Co32-)
-Rubidio monoksida, RB2Atau (rb2+Sama ada2-)
-Rubidium Superoxide, RBO2 (RB+Sama ada2-)
Walaupun sangat jarang berlaku, rubidium juga boleh mempunyai nombor pengoksidaan negatif: -1 (RB-). Dalam kes ini, kita akan bercakap tentang "rubidiuro" jika dia membentuk kompaun dengan elemen elektronegatif yang kurang daripada dia, atau jika dia diserahkan di bawah keadaan khas dan ketat.
Kelompok
Terdapat sebatian di mana setiap atom RB mempunyai nombor pengoksidaan dengan nilai pecahan. Contohnya, dalam RB6Atau (rb62+Sama ada2-) dan rb9Sama ada2 (RB94+Sama ada22-) Beban positif diedarkan di antara satu set atom RB (kelompok). Oleh itu, dalam RB6Atau nombor pengoksidaan dalam teori ialah +1/3; Semasa berada di RB9Sama ada2, + 0.444 (4/9).
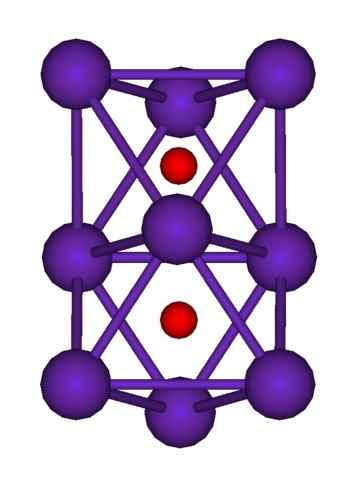 Struktur kluster RB9O2. Sumber: Axiosaurus [Domain Awam]
Struktur kluster RB9O2. Sumber: Axiosaurus [Domain Awam] Struktur kluster RB ditunjukkan di atas9Sama ada2 diwakili oleh model sfera dan bar. Perhatikan bagaimana sembilan atom RB "melampirkan" anion atau2-.
Dengan cara elucubration, seolah -olah sebahagian daripada kristal logam asal rubidium tetap tidak berubah semasa memisahkan dari kristal ibu. Mereka kehilangan elektron dalam proses; yang diperlukan untuk menarik atau2-, dan caj positif yang dihasilkan diedarkan di antara semua atom kluster tersebut (set atau agregat atom RB).
Oleh itu, dalam kelompok rubidium ini, kewujudan RB tidak dapat diandaikan secara rasmi+. Rb6Atau dan rb9Sama ada2 Mereka mengklasifikasikan sebagai suboksida rubidium, di mana anomali yang jelas ini dipenuhi untuk mempunyai lebihan atom logam berhubung dengan anion oksida.
Di mana dan dapatkan
Kerak bumi
 Sampel mineral lepidolit. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Sampel mineral lepidolit. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Rubidio adalah elemen paling banyak 23 kerak bumi, dengan kelimpahan yang setanding dengan logam zink, plumbum, cesium dan tembaga. Perinciannya adalah bahawa ion mereka disebarkan secara meluas, jadi ia tidak mendominasi di mana -mana mineral sebagai elemen logam utama, dan bijih mereka juga terhad.
Boleh melayani anda: Grignard Reagent: Penyediaan, Aplikasi, ContohOleh sebab itu, Rubidio adalah logam yang sangat mahal, bahkan lebih daripada emas yang sama, kerana proses mendapatkannya dari menasnya adalah kompleks kerana kesukaran eksploitasinya.
Secara semula jadi, memandangkan kereaktifannya, rubidium tidak berada dalam keadaan asli, tetapi sebagai oksida (RB2O), klorida (RBCL) atau disertai dengan anion lain. Ion -ion RB "percuma"+ Mereka berada di lautan dengan kepekatan 125 μg/L, serta di mata air panas dan sungai.
Di antara mineral kerak bumi yang mengandungi kepekatan kurang dari 1% yang kita ada:
-Leucita, K [alsi2Sama ada6]
-Polucita, CS (ya2Helo6· NH2Sama ada
-Cannalita, Kmgcl3· 6h2Sama ada
-Zinnwaldita, Klifeal (ALSI3) Sama ada10(Oh, f)2
-Amazonita, PB, Kalsi3Sama ada8
-Petalita, Lialsi4Sama ada10
-Biotita, K (MG, Iman)3Alsi3Sama ada10(Oh, f)2
-Rubiclina, (RB, K) Alsi3Sama ada8
-Lepidolita, K (Li, AL)3(Ya, Al)4Sama ada10(F, oh)2
Persatuan Geokimia
Semua mineral ini berkongsi satu atau dua perkara yang sama: mereka adalah kalium, cesium atau silikat litium, atau garam mineral logam ini.
Ini bermakna Rubidio mempunyai kecenderungan yang kuat untuk mengaitkan dengan kalium dan cesio; Ia juga boleh menggantikan kalium semasa penghabluran mineral atau batu, seperti yang berlaku di ladang pegmatitas ketika magma mengkristal. Oleh itu, Rubidio adalah hasil sampingan eksploitasi dan penapisan batu -batu dan mineral mereka.
Rubidio juga boleh berada di batu biasa seperti granit, tanah liat dan basalt, dan juga deposit karbon. Dari semua sumber semula jadi, lepidolit mewakili bijih utamanya dan dari mana ia dieksploitasi secara komersial.
Di kalangan manusia, sebaliknya, Rubidio boleh didapati sebagai kekotoran RBCL dengan kandungan 0.035%. Dan dalam kepekatan yang lebih besar terdapat deposit polucitas dan rubiclinas, yang boleh mempunyai sehingga 17% rubidium.
Persatuan geokimia dengan kalium adalah disebabkan oleh persamaan radio ioniknya; Rb+ lebih besar daripada k+, Tetapi perbezaan saiz bukanlah halangan untuk yang pertama menggantikan yang kedua dalam kristal mineralnya.
Penghabluran fraksional
Sama ada berdasarkan lepidolit atau polucita, atau mana -mana mineral yang disebutkan di atas, cabaran tetap sama dengan tahap yang lebih besar atau lebih rendah: memisahkan rubidium dari kalium dan cesium; iaitu, gunakan teknik pemisahan campuran yang membolehkan sebatian atau garam rubidium di satu pihak, dan kalium dan cesium, di sisi lain.
Ini sukar kerana ion ini (k+, Rb+ dan CS+) berkongsi persamaan kimia yang hebat; Mereka bertindak balas dengan cara yang sama untuk membentuk garam yang sama, yang hampir tidak berbeza antara satu sama lain terima kasih kepada kepadatan dan kelarutan mereka. Itulah sebabnya penghabluran yang dikecualikan digunakan, supaya mereka perlahan -lahan dan dikawal.
Sebagai contoh, teknik ini digunakan untuk memisahkan campuran karbonat dan alum dari logam ini. Proses penghabluran semula harus diulang beberapa kali untuk menjamin kristal muktamad dan bebas ion -ion yang disalin; Garam rubidium yang mengkristal dengan ion k+ atau CS+ di permukaan atau di dalamnya.
Teknik yang lebih moden, seperti penggunaan resin pertukaran ion, atau mahkota sebagai agen kompleks, juga membolehkan ion RB+.
Elektrolisis atau pengurangan
Sebaik sahaja ia mungkin untuk memisahkan dan membersihkan garam rubid, langkah seterusnya dan terakhir adalah untuk mengurangkan kation rb+ kepada logam pepejal. Untuk melakukan ini, garam cair dan tertakluk kepada elektrolisis untuk mendakan rubidium dalam katod; atau ejen pengurangan yang kuat, seperti kalsium dan natrium, digunakan, mampu kehilangan elektron dengan cepat dan dengan itu mengurangkan rubidium.
Isotop
Rubidio ditemui di bumi sebagai dua isotop semulajadi: 85Rb dan 87Rb. Yang pertama mempunyai banyak 72.17%, manakala yang kedua daripada 27.83%.
Dia 87RB bertanggungjawab untuk logam ini menjadi radioaktif; Walau bagaimanapun, radiasinya tidak berbahaya dan juga bermanfaat untuk analisis temu janji. Half -life anda (t1/2) adalah 4.9 · 1010 tahun, yang tempoh masa melebihi umur alam semesta. Apabila ia mereput, ia menjadi isotop yang stabil 87Encik.
Terima kasih kepada ini, isotop ini telah digunakan untuk berkencan dengan umur mineral dan batu tanah yang hadir sejak permulaan bumi.
Sebagai tambahan kepada isotop 85Rb dan 87RB, terdapat sintetik dan radioaktif yang lain dengan pembolehubah dan masa hidup yang lebih pendek; Contohnya, dia 82RB (t1/2= 76 saat), 83RB (t1/2= 86.2 hari), 84RB (t1/2= 32.9 hari) dan 86RB (t1/2= 18.7 hari). Dari mereka semua, 82RB adalah yang paling banyak digunakan dalam kajian perubatan.
Risiko
Logam
Rubidio adalah logam yang begitu reaktif sehingga ia mesti disimpan dalam ampul kaca di bawah suasana lengai sehingga tidak bertindak balas dengan oksigen udara. Jika berkata pecah ampoule, logam boleh diletakkan di minyak tanah atau minyak mineral untuk melindunginya; Walau bagaimanapun, ia akan mengoksidakan oksigen terlarut di dalamnya, menimbulkan rubidium peroksida.
Ia boleh melayani anda: Natrium Cyanide (NACN): Struktur, Hartanah, Risiko, KegunaanSekiranya sebaliknya ia diputuskan untuk meletakkannya di atas kayu, sebagai contoh, ia akan terbakar dengan api ungu. Sekiranya terdapat banyak kelembapan, ia akan terbakar dengan fakta yang terdedah kepada udara. Apabila sekeping besar rubidium dielakkan pada jumlah air, ia mengeksploitasi dengan kuat, mencapai gas yang dihasilkan oleh hidrogen.
Oleh itu, rubidium adalah logam yang harus dimanipulasi, kerana semua reaksinya boleh diletupkan secara praktikal.
Ion
Tidak seperti rubidium logam, ion RBnya+ Mereka tidak mewakili risiko yang jelas untuk makhluk hidup. Ini dibubarkan dalam air berinteraksi dengan sel dengan cara yang sama seperti yang dilakukan oleh k+.
Oleh itu, rubidium dan kalium mempunyai tingkah laku biokimia yang sama; Walau bagaimanapun, rubidium bukan elemen penting, sementara kalium ya. Dengan cara ini, jumlah RB yang cukup besar+ Mereka boleh berkumpul di bahagian dalam sel, sel darah merah dan viscera tanpa memberi kesan negatif terhadap badan haiwan.
Malah, telah dianggarkan bahawa seorang lelaki dewasa dengan jisim 80 kg mengandungi kira -kira 37 mg Rubidio; Dan sebagai tambahan, peningkatan kepekatan ini mengikut urutan 50 hingga 100 kali tidak membawa kepada gejala yang tidak diingini.
Walau bagaimanapun, ion RB yang berlebihan+ boleh akhirnya bergerak ke k ion+; Dan akibatnya, individu akan mengalami kekejangan otot yang sangat kuat sehingga mati.
Secara logiknya, garam salvor atau sebatian rubidium dapat mencetuskannya dengan segera, sehingga tidak ada yang harus ditelan. Di samping itu, ia boleh menyebabkan luka bakar mudah, dan antara fluorida yang paling toksik (RBF), hidroksida (RBOH) dan sianida (RBCN) rubidium.
Aplikasi
Pemungut Gas
Rubidio telah digunakan untuk menangkap atau menghapuskan jejak gas yang mungkin wujud di dalam tiub yang dimeteraikan vakum. Tepat kerana kecenderungan mereka yang tinggi untuk menangkap oksigen dan kelembapan di dalamnya, mereka menghapuskannya di permukaan mereka sebagai peroksida.
Pyrotechnics
Apabila garam rubidio membakar api violet-reddish ciri. Beberapa bunga api mempunyai garam ini dalam komposisi mereka sehingga mereka meletup dengan warna -warna ini.
Tambahan
Rubidio Chloride telah ditetapkan untuk memerangi kemurungan, kerana kajian menentukan defisit elemen ini pada individu yang menderita keadaan perubatan ini. Ia juga telah digunakan sebagai sedatif dan merawat epilepsi.
Bose-Einstein Condensate
Atom isotop 87RB digunakan untuk membuat kondensat Bose-Einstein pertama. Keadaan ini adalah bahawa atom pada suhu agak dekat dengan sifar mutlak (0 k), dikelompokkan atau "kondensan", berkelakuan seolah -olah mereka adalah satu.
Oleh itu, Rubidio adalah protagonis kemenangan ini dalam bidang fizik, dan ia adalah Eric Cornell, Carl Wieman dan Wolfgang Ketterle yang menerima Hadiah Nobel pada tahun 2001 terima kasih kepada karya ini.
Diagnosis tumor
Radioisotop sintetik 82RB mereput dengan memancarkan positrones, yang digunakan untuk mengumpul dalam tisu kalium; Seperti yang terletak di otak atau jantung. Oleh itu, ia digunakan untuk menganalisis fungsi jantung dan kehadiran tumor yang mungkin di otak melalui tomografi pelepasan positron.
Komponen
Ion Rubidio telah menemui ruang dalam pelbagai jenis bahan atau campuran. Sebagai contoh, aloi mereka dengan emas, cesium, merkuri, natrium dan kalium telah dibuat. Ia telah ditambah kepada kaca dan seramik mungkin untuk meningkatkan titik lebur mereka.
Di sel solar perovskitas mereka telah ditambah sebagai komponen penting. Begitu juga, penggunaannya yang mungkin telah dikaji sebagai penjana thermoelectric, bahan penghantaran haba di ruang angkasa, bahan bakar dalam motor pendorong ionik, medium elektrolitik untuk bateri alkali dan magnetometer atom.
Jam tangan atom
Dengan rubidium dan berhenti, jam tangan atom yang terkenal telah dihasilkan, sangat tepat, digunakan sebagai contoh dalam satelit GPS yang mana pemilik telefon pintar mereka dapat mengetahui lokasi mereka semasa bergerak di jalan.
Rujukan
- Bond Tom. (29 Oktober 2008). Rubidium. Pulih dari: dunia kimia.com
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Rubidium. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Rubidium. Pangkalan data PUBCHEM. CID = 5357696. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Chellan, ms., & Sadler, p. J. (2015). Unsur kehidupan dan ubat -ubatan. Urus niaga falsafah. Siri A, Sains Matematik, Fizikal, dan Kejuruteraan, 373 (2037), 20140182. Doi: 10.1098/RSTA.2014.0182
- May asas pendidikan dan penyelidikan perubatan. (2019). Rubidium RB 82 (laluan intravena). Pulih dari: mayoklinik.org
- Marques Miguel. (s.F.). Rubidium. Pulih dari: nautilus.Fis.UC.Pt
- James l. Pewarna. (12 April 2019). Rubidium. Encyclopædia Britannica. Pulih dari: Britannica.com
- Dr. Doug Stewart. (2019). Fakta unsur Rubidium. Chemicool. Pulih dari: chemicool.com
- Michael Pilgaard. (10 Mei 2017). Reaksi Kimia Rubidium. Pulih dari: pilgaardelegs.com

