Formula Garam Asas, Hartanah, Nomenclature, Contoh

- 3743
- 650
- Clarence Greenholt DDS
The garam asas Mereka semua yang larut dalam air menjana penyelesaian dengan nilai pH lebih besar daripada 7. Ini dijelaskan oleh pembentukan oh ion-, yang datang terus dari proses pembubaran atau keseimbangan hidrolisis di mana anion mengambil bahagian.
Garam asas mengandungi anion oh- Dalam pepejal mereka. Sebagai contoh, hidroksida alkali, seperti natrium dan kalium, NaOH dan KOH, dianggap ahli garam ini; Walaupun mereka sangat kaustik, itulah sebabnya mereka berhak mendapat denominasi hidroksida dan bukannya dipanggil garam.
 Natrium hidroksida adalah contoh garam asas
Natrium hidroksida adalah contoh garam asas Garam asas lain sebaliknya mempunyai anion seperti Carbonate, CO32-. Karbonat berasal dari asid karbonik, h2Co3, Asid lemah. Oleh itu, garam karbonat, seperti kalsium karbonat yang digunakan dalam antacid, diklasifikasikan sebagai garam asas. Penalaran yang sama berlaku untuk natrium bikarbonat, nahco3, Dan untuk semua garam bikarbonat lain.
Garam asas adalah penting kerana beberapa daripada mereka membantu meneutralkan keasidan makanan. Mereka juga boleh digunakan untuk menyediakan penyelesaian redaman ke pH alkali.
[TOC]
Definisi
Garam asas mempunyai dua definisi yang saling melengkapi: mereka mengandungi anion oh- Dalam pepejal mereka, atau menghasilkan anion hidroksili yang sama sekali kristal mereka dibubarkan di dalam air.
Tidak kira definisi yang dipilih, pH penyelesaian berairnya akan lebih besar daripada 7, dan oleh itu, mereka akan menjadi alkali atau asas.
Formula umum garam asas
Menjelaskan apa yang difahami oleh garam asas, formulanya, walaupun tidak ketat umum, adalah seperti berikut:
Mn(Oh)WXOv
Di mana m adalah kation logam atau ammonium, oh hidroksil, dan xo anion yang diperolehi dari asid yang lemah atau kuat. Subskrip n, W dan v berapa m, oh dan xo, masing -masing, membentuk garam asas, serta perkadaran mereka.
Perhatikan bahawa v Ia boleh sama dengan sifar, yang bermaksud bahawa kita mempunyai alkali atau alkalinoterreo hidroksida. Inilah yang berlaku dengan Naoh dan Koh. Begitu juga, W Ia boleh menjadi sifar, yang bermaksud tidak ada ion oh-. Contohnya, Caco3 Ia tidak mempunyai oh-, Namun ia tetap menjadi garam asas.
Boleh melayani anda: kalsium sulfida (CAS): struktur, sifat, mendapatkan, menggunakanDari yang di atas disimpulkan bahawa formula umum garam asas adalah mn(Oh)WXOv, Tetapi tidak semua garam mematuhi ini. Oleh itu, faktor yang lebih penting untuk diambil kira adalah sifat anion xo. Oleh itu, ia akan dikenali apabila garam adalah asas, tanpa mengira sama ada ia mempunyai ion oh- Dalam formula mereka.
Sifat garam asas
Garam asas larut dalam air berikutan persamaan berikut:
Mn(Oh)WXOv(s) → nM+(Ac) + WOh-(Ac) + vXO-(Ac)
Perhatikan bahawa apabila ia larut melepaskan ion oh- dalam air. Ini mempengaruhi pH penyelesaian, menjadi alkali dengan nilai lebih besar daripada 7. Sebagai contoh, nitrat kalsium asas larut di dalam air mengikut bagaimana ia mengikuti:
CA (OH) Tidak3(s) → ca2+(Ac) + oh-(ac) + tidak3-(Ac)
Nilai -nilai n, W dan v Mereka sama dengan 1 untuk garam ini.
Sebaliknya, garam asas yang tidak mempunyai oh-, Tetapi anion yang diperoleh dari asid lemah dihidrolisiskan di dalam air:
Pencuri3(s) → ca2+(ac) + co32-(Ac)
Co32-(Ac) + h2Atau (l) ⇌ HCO3-(Ac) + oh-(Ac)
Perhatikan bahawa produk hidrolisis ini adalah anion oh-. Dari situ terletak kealkalian pangkalan -pangkalan ini. Walau bagaimanapun, dan seperti yang dijangkakan, mereka kurang asas daripada yang sudah mempunyai ion oh- hadir dalam kristal mereka. Sebagai contoh, NaOH sangat asas:
NaOH (s) → NA+(Ac) + oh-(Ac)
Nah, lepaskan oh ion- secara langsung sebaik sahaja air menyentuh; Atau lebih teruk, hampir tidak menyentuh kelembapan kulit.
Boleh melayani anda: Carbocation: pembentukan, ciri, jenis, kestabilanSifat fizikal atau kimia lain garam asas tidak terlalu berbeza daripada garam neutral atau asid lain.
Nomenclature
Nomenklatur garam asas bergantung pada sifat anion xo: jika ia monoatomik, atau jika ia adalah oxoanion. Walau bagaimanapun, bahagian ini akan memberi tumpuan terutama pada garam asas dengan anion oh-. Mereka yang tidak memilikinya, mempunyai nomenclatures yang lebih mudah untuk menghafal atau membuat alasan.
Dengan anion monoatomik
Anion monoatomik tidak diwakili sebagai xo, tetapi sebagai x. Mereka berasal dari hydraceide Hx, seperti asid fluorida, HF, atau asid hidroklorik, HCl, dan sebagainya.
Dalam kes ini, mereka dinamakan secara sistematik dalam dua cara:
(Awalan angka kecuali monyet) Hydroxi + nama anion yang berakhir dengan akhiran -uro + nama logam dengan valensinya dalam kurungan (jika ia mempunyai lebih dari satu)
Sebagai contoh, garam Ni (OH) CL dipanggil Nickel Hydroxychloride (II).
Nama anion dengan penamatan -uro + -(awalan angka kecuali monyet) hidroksida + nama logam dan valensinya dalam kurungan
Sebagai contoh, garam Ni (OH) CL juga boleh dinamakan sebagai nikel klorida-hydroxide (II).
Kami juga mempunyai tatanama tradisional, kadang -kadang bercampur dengan sistematik:
Nama anion diikuti oleh (awalan angka kecuali monyet) asas dan nama logam dengan akhiran -ooso atau -ico seperti yang digunakan.
Sebagai contoh, Ni (OH) CL dipanggil nikel asas klorida, atau nikel asas klorida (II).
Dengan oxoanion
Nomenklatur sistematik untuk garam asas yang mempunyai oxoanions sedikit lebih rumit. Walau bagaimanapun, versi paling mudah dibina seperti berikut:
(Awalan angka) hidroksida- (nama anion) + nama logam dan valencia dalam kurungannya
Contohnya, Iman (OH) Tidak3 dipanggil: hidroksida-besi nitrat (ii).
Ia juga mempunyai tatanama tradisional:
Asas Nion + (awalan angka) nama + nama logam yang berakhir di -oso atau -ico
Boleh melayani anda: oksigen: sifat, struktur, risiko, kegunaanOleh itu, iman (oh) tidak3 Ia dipanggil: nitrat asas ferus, atau nitrat besi asas (ii).
Latihan
Garam asas adalah hasil daripada neutralizations asid-asas, khususnya antara hidrasi atau oxoacid dengan lebihan asas atau hidroksida:
Asas (berlebihan) + asid → garam asas atau alkali + air
Contohnya, CA (OH) Tidak3 Ia dibentuk dengan meneutralkan asid nitrik dengan lebihan kalsium hidroksida:
CA (oh)2(Berlebihan) + hno3 → CA (OH) Tidak3 + H2Sama ada
Satu lagi pembentukan latihan adalah seperti berikut:
Iman (oh)3(Berlebihan) + h2SW4 → Fe (oh) So4 + 2h2Sama ada
Garam ini dipanggil: sulfat ferrik asas, sulfat besi asas (III), atau besi hidroksida-sulfat (iii).
Contoh garam asas
 Antacid, seperti kalsium karbonat, CaCO3, adalah contoh garam asas. Sumber: Pixabay.
Antacid, seperti kalsium karbonat, CaCO3, adalah contoh garam asas. Sumber: Pixabay. Akhirnya, beberapa contoh garam asas akan disenaraikan bersama dengan nama yang lebih mudah:
-Nach3COO: Natrium asetat
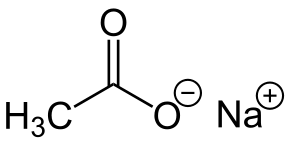 Natrium asetat
Natrium asetat -Na2S: Natrium sulfida
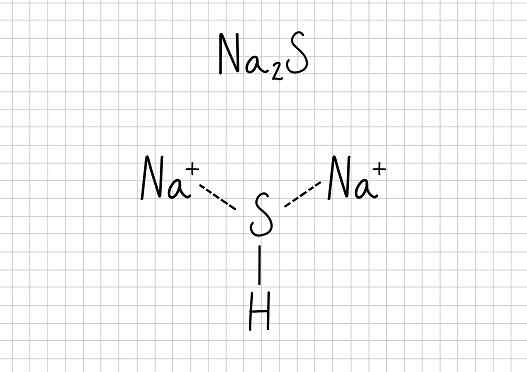 Natrium sulfida
Natrium sulfida -KCN: Potassium Cyanide
-Mgco3: Magnesium karbonat
-Iman (OH) Jadi3: Sulfit besi asas (iii)
-Iman (OH) (c6H5COO)2: Benzoate Iron Basic (iii)
-AUCL (oh)2: Klorida Dibasic Emas (III)
-Cuclo3(OH): Klorat Tembaga Asas (II)
-Di (oh) jadi4: Aluminium sulfat asas
-PB (OH)2Co3: Dibasic Lead Carbonate (IV)
Masalah garam asas adalah bahawa tidak semuanya dapat disediakan, kerana lebihan asas atau hidroksida tidak cukup untuk mengkristalisasi mereka tanpa menggunakan proses lain. Itulah kes PB (OH)2Co3. Walau bagaimanapun, karbonat ini wujud sebagai pigmen plumbum putih (ii), yang formulanya ialah 2PBCO3· PB (OH)2 atau PB3(Oh)2(Co3)2.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Garam alkali. Diperoleh dari: dalam.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1 Julai 2014). Sifat asid garam. Pulih dari: chem.Libretxts.org
- Nicola McDougal. (2020). Penyelesaian Garam Asid & Asas: Penjelasan & Contoh. Kajian. Pulih dari: belajar.com
- Masalah dan latihan kimia. (s.F.). Garam asas. Pulih dari: acoral.adalah

