Penyelesaian pekat
- 2218
- 647
- Erick Krajcik
Apakah penyelesaian yang tertumpu?
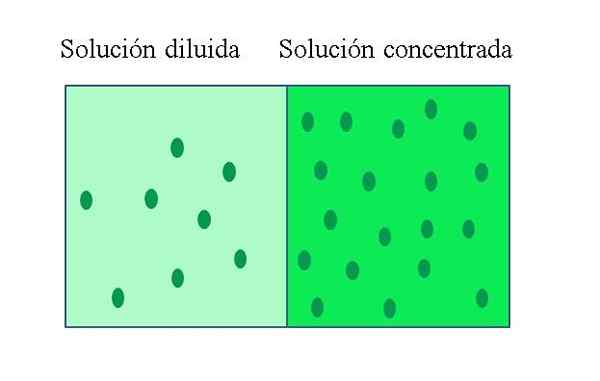
A penyelesaian pekat Ia adalah salah satu yang mengandungi sejumlah besar larut berhubung dengan jumlah yang dapat dibubarkan. Sebaliknya, penyelesaian yang dicairkan mempunyai kepekatan rendah larut. Penyelesaian yang dicairkan boleh disediakan dari penyelesaian pekat dengan menambahkan pelarut, atau jika boleh, mengekstrak larut.
Konsep ini boleh menjadi relatif, kerana apa yang mentakrifkan penyelesaian pekat adalah nilai yang tinggi dalam beberapa sifatnya; Contohnya, meringue mantecado mempunyai kepekatan gula yang tinggi, yang terbukti dengan rasa manisnya.
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Kepekatan larutan larutan pekat adalah hampir atau sama dengan yang ada dalam larutan tepu. Ciri utama penyelesaian tepu adalah bahawa ia tidak dapat melarutkan jumlah tambahan larut pada suhu tertentu. Oleh itu, kepekatan larut dalam penyelesaian tepu tetap tetap.
Kelarutan, kebanyakan larutan, meningkat apabila suhu meningkat. Dengan cara ini, anda dapat menyelesaikan solubilkan jumlah larutan tambahan dalam larutan tepu.
Kemudian dengan mengurangkan suhu, kepekatan larutan larutan tepu meningkat. Bercakap adalah kes penyelesaian supersaturated ini.
Ciri penyelesaian pekat
Kepekatan penyelesaian, iaitu, hubungan antara jumlah larut dan jumlah penyelesaian atau pelarut, boleh dinyatakan sebagai peratusan larut dalam larutan (P/V atau P/P).
Ia juga boleh dinyatakan dalam tahi lalat dari larutan larutan larutan (molariti) dan setara larut setiap liter penyelesaian (normalisasi).
Ia juga biasa untuk menyatakan kepekatan larutan dalam tahi lalat pelarut setiap kilogram pelarut (moleality) atau menyatakannya dalam tahi lalat yang berkaitan dengan jumlah tahi lalat (pecahan molar). Dalam penyelesaian yang dicairkan, adalah perkara biasa untuk mencari kepekatan penyelesaian dalam p.p.m. (bahagian per juta).
Boleh melayani anda: kelikatan: contoh, sebab, unit, jenisApa pun bentuk ekspresi kepekatan penyelesaian, penyelesaian pekat mempunyai sebahagian besar larut, dalam kes ini dinyatakan sebagai jisim, berhubung dengan jisim atau jumlah penyelesaian atau pelarut. Kerana kepekatan ini sama dengan kelarutan larut dalam pelarut atau sangat dekat dengan nilainya.
Ciri -ciri penyelesaian penyelesaian
Mereka adalah satu set sifat penyelesaian yang bergantung kepada bilangan zarah dalam penyelesaian tanpa mengira jenisnya.
Ciri -ciri koligatif tidak mendiskriminasi antara ciri -ciri zarah, jika mereka adalah natrium, klorin, glukosa, dll. Yang penting ialah nombor anda.
Oleh kerana fakta ini, adalah perlu untuk mewujudkan cara yang berbeza untuk menyatakan kepekatan penyelesaian yang berkaitan dengan sifat -sifat koligatif yang dipanggil. Sebagai tindak balas terhadap ini, ungkapan osmolariti dan osmolality dicipta.
Osmolarity dan osmolality
Osmolarity berkaitan dengan molariti penyelesaian dan osmolality dengan moleality.
Unit osmolariti adalah OSM/L penyelesaian atau moSM/L penyelesaian. Walaupun unit osmolality adalah OSM/kg air atau mosm/kg air.
Osmolarity = mvg
m = molariti penyelesaian.
v = bilangan zarah di mana sebatian dalam larutan berair memisahkan. Sebagai contoh: untuk NaCl, V mempunyai nilai 2; Untuk CACL2, V mempunyai nilai 3 dan untuk glukosa, sebatian bukan elektrolitik yang tidak dipisahkan, v mempunyai nilai 1.
G = pekali osmotik, faktor pembetulan untuk interaksi zarah -zarah yang dikenakan elektrik dalam larutan. Faktor pembetulan ini mempunyai nilai yang hampir kepada 1 untuk penyelesaian yang dicairkan dan cenderung kepada sifar kerana molariti sebatian elektrolitik meningkat.
Boleh melayani anda: mortar makmal: ciri, fungsi, kegunaanCiri -ciri koligatif disebutkan di bawah, yang membolehkan untuk menentukan berapa banyak penyelesaian yang tertumpu.
Tekanan stim jatuh
Apabila air dipanaskan, penyejatan dan stim terbentuk memberi tekanan. Apabila soluto ditambah, tekanan stim berkurangan.
Oleh itu, penyelesaian pekat mempunyai tekanan stim yang rendah. Penjelasannya ialah molekul larut bergerak ke molekul air di antara muka Agua-Aire.
Titik crioscopic menurun
Oleh kerana osmolariti larutan meningkatkan suhu di mana larutan berair dibekukan. Sekiranya suhu pembekuan air tulen adalah 0º C, suhu pembekuan larutan berair pekat adalah lebih rendah daripada nilai itu.
Ketinggian titik embullition
Menurut undang -undang Raault, ketinggian titik mendidih pelarut tulen adalah berkadar terus dengan molariti penyelesaian yang berasal dengan penambahan larut. Oleh itu, penyelesaian pekat mempunyai titik mendidih yang lebih tinggi daripada air.
Tekanan osmotik
Terdapat dua petak dengan kepekatan yang berbeza, dipisahkan oleh membran yang membolehkan air lulus, tetapi yang menyekat laluan zarah larut.
Air akan mengalir dari larutan yang mempunyai kepekatan yang lebih rendah larut ke larutan yang mempunyai kepekatan yang lebih besar larut.
Aliran bersih air ini akan hilang kerana air terkumpul di dalam petak dengan kepekatan tertinggi menghasilkan tekanan hidrostatik yang menentang aliran air ke dalam petak ini.
Ia dapat melayani anda: diphenylamineAliran air oleh osmosis umumnya berlaku ke arah penyelesaian pekat.
Perbezaan antara penyelesaian pekat dan penyelesaian yang dicairkan
-Penyelesaian pekat mempunyai bahagian larut yang tinggi berhubung dengan jumlah atau jisim penyelesaian. Penyelesaian yang dicairkan mempunyai bahagian larut rendah berhubung dengan jumlah atau jisim penyelesaiannya.
-Mereka mempunyai molariti, molealitas dan normalisasi yang lebih besar daripada yang dibentangkan oleh penyelesaian yang dicairkan.
-Titik pembekuan penyelesaian pekat adalah lebih rendah daripada penyelesaian yang dicairkan; iaitu, mereka membekukan pada suhu yang lebih sejuk.
-Penyelesaian pekat mempunyai tekanan stim yang kurang daripada penyelesaian yang dicairkan.
-Penyelesaian pekat mempunyai titik mendidih yang lebih tinggi daripada yang dibentangkan oleh penyelesaian yang dicairkan.
-Hubungi melalui membran semipermeable, air akan mengalir dari penyelesaian yang dicairkan ke penyelesaian pekat.
Contoh penyelesaian
Tertumpu
-Madu adalah penyelesaian gula tepu. Adalah biasa untuk memerhatikan berlakunya pemasangan semula gula, yang dibuktikan dalam tapas bekas yang mengandungi madu.
-Air laut yang mempunyai kepekatan tinggi pelbagai garam.
-Air kencing dari orang yang mengalami dehidrasi teruk.
-Air berkarbonat adalah penyelesaian karbon dioksida tepu.
Dicairkan
-Air kencing seseorang yang mempunyai pengambilan air yang berlebihan.
-Peluh biasanya osmolariti rendah.
-Banyak ubat yang dibekalkan dalam penyelesaian mempunyai kepekatan yang rendah.
Rujukan
- Wikipedia. Konsentrasi. Pulih dari: Adakah.Wikipedia.org
- Fusta l. Kepekatan Penyelesaian: Definisi & Tahap. Kajian. Pulih dari: belajar.com
- Penyelesaian berair - molariti. Pulih dari: chem.UCLA.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.

