Solvation
- 1055
- 22
- Dallas Bernhard
Apa solvation?
The Solvation Ia adalah kesatuan fizikal dan kimia antara zarah larut dan pelarut dalam larutan. Ia berbeza dari konsep kelarutan pada hakikatnya bahawa tidak ada keseimbangan termodinamik antara zarah pepejal dan larut.
Kesatuan ini bertanggungjawab untuk pepejal yang dibubarkan "hilang" memandangkan penonton; Ketika pada hakikatnya, zarah menjadi sangat kecil dan akhirnya "dibungkus" oleh lembaran molekul pelarut, yang menjadikan mereka mustahil untuk memerhatikannya.

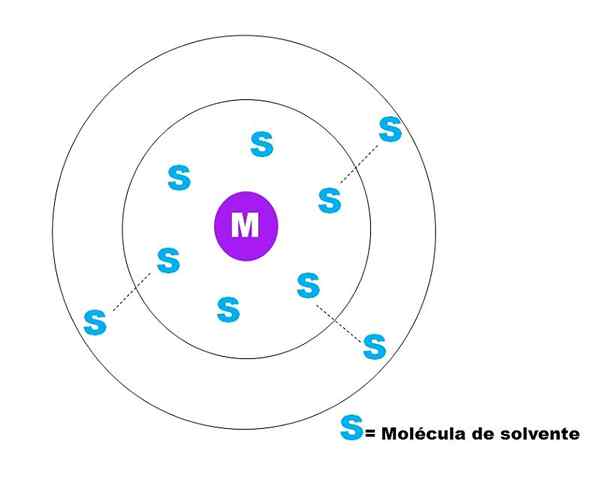
Di bahagian atas, lakaran yang sangat umum mengenai solvation zarah m diwakili. M boleh baik -baik saja (m+) atau molekul; Dan s adalah molekul pelarut, yang boleh menjadi sebatian dalam keadaan cair (walaupun ia juga boleh menjadi gas).
Perhatikan bahawa m dikelilingi oleh enam s s, yang membentuk apa yang dikenali sebagai Sfera solvation utama. Molekul m lain pada jarak yang lebih tinggi berinteraksi oleh van der Waals memaksa dengan bekas, membentuk sfera solverasi sekunder, dan sebagainya sehingga sebarang pesanan jelas.
Proses solvation
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Secara molekul, bagaimana proses solvation? Gambar atas meringkaskan langkah -langkah yang diperlukan.
Molekul pelarut, biru, pada mulanya diperintahkan untuk berinteraksi antara satu sama lain (S-S); Dan zarah (ion atau molekul) larut, ungu, melakukan perkara yang sama dengan interaksi M-M yang kuat atau lemah.
Untuk membuat solvation berlaku, kedua-dua pelarut dan larut mesti berkembang (anak panah hitam kedua) untuk membolehkan interaksi pelarut larut (M-S).
Ini semestinya menunjukkan penurunan dalam interaksi pelarut dan pelarut larut; penurunan yang memerlukan tenaga, dan oleh itu, langkah pertama ini adalah endotermik.
Sebaik sahaja pelarut dan pelarut telah berkembang secara molekul, kedua -dua tempat campuran dan pertukaran di ruang angkasa. Setiap bulatan ungu imej kedua dapat dibandingkan dengan imej pertama.
Boleh melayani anda: kalsium: sifat, struktur, mendapatkan, menggunakanPerubahan dalam tahap pesanan zarah boleh terperinci dalam imej; dipesan pada mulanya, dan kemas pada akhirnya. Akibatnya, langkah terakhir adalah eksotermik, kerana pembentukan interaksi baru menstabilkan semua zarah penyelesaian.
Aspek tenaga
Di belakang proses solvation, terdapat banyak aspek tenaga yang mesti diambil kira. Pertama: Interaksi S-S, M-M dan M-S.
Apabila interaksi M-S, iaitu, antara pelarut dan pelarut, mereka lebih unggul (kuat dan stabil) berbanding dengan komponen individu, terdapat perbincangan mengenai proses solverasi eksotermik; Dan oleh itu, tenaga dilepaskan ke alam sekitar, yang dapat disahkan dengan mengukur peningkatan suhu dengan termometer.
Jika, sebaliknya, interaksi M-M dan S-S lebih kuat daripada M-S, maka untuk "mengembangkan" akan memerlukan lebih banyak tenaga daripada yang mereka perolehi sekali solvation memuncak.
Ada yang bercakap mengenai proses solverasi endotermik. Menjadi kes ini, terdapat penurunan suhu, atau apa yang sama, persekitarannya sejuk.
Terdapat dua faktor asas yang memerintah sama ada atau tidak larut larut dalam pelarut. Yang pertama ialah perubahan penyelesaian pembubaran (ΔHDis), Seperti yang dijelaskan, dan yang kedua adalah perubahan entropi (Δs) antara larutan dan larutan terlarut. Umumnya, ΔS dikaitkan dengan peningkatan gangguan juga yang disebutkan di atas.
Interaksi intermolecular
Telah disebutkan bahawa solvation adalah hasil dari kesatuan fizikal dan kimia antara larutan dan pelarut; Namun, betapa tepatnya interaksi atau kesatuan ini?
Sekiranya larutan adalah ion, m+, Interaksi ion-dipolo yang dipanggil dihasilkan (m+-S); Dan jika ia adalah molekul, maka akan ada interaksi dipole-dipolo atau daya penyebaran London.
Boleh melayani anda: Cyclohexane: Struktur, Kegunaan, KonformasiSemasa bercakap mengenai interaksi Dipolo-dipolo, dikatakan bahawa terdapat momen dipole kekal di m dan s. Oleh itu, rantau ini kaya dengan elektron δ- dari m berinteraksi dengan kawasan miskin elektron δ+ s. Hasil dari semua interaksi ini adalah pembentukan beberapa sfera solvation di sekitar m.
Di samping itu, terdapat jenis interaksi lain: koordinasi. Di sini, molekul pautan koordinasi bentuk s (atau datif) dengan m, membentuk pelbagai geometri.
Peraturan asas untuk menghafal dan meramalkan pertalian antara larutan dan pelarut adalah: Sama larut sama. Oleh itu, bahan kutub dibubarkan dengan mudah dalam pelarut sama -sama kutub; dan bahan apolar, larut dalam pelarut apolar.
Perbezaan antara solvation dan penghidratan
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Bagaimana solverasi penghidratan berbeza? Dua proses yang sama, kecuali kerana S S, imej pertama, digantikan oleh air, H-O-H.
Dalam imej yang unggul, anda dapat melihat kation m+ dikelilingi oleh molekul enam h2Sama ada. Perhatikan bahawa atom oksigen (merah) diarahkan kepada beban positif, kerana ia adalah elektronegatif yang paling dan oleh itu mempunyai ketumpatan negatif yang paling besar δ-.
Di belakang sfera penghidratan pertama, molekul air lain dikelompokkan oleh jambatan hidrogen (oh2-Oh2). Ini adalah interaksi jenis ion-dipolo. Walau bagaimanapun, molekul air juga boleh membentuk ikatan koordinasi dengan pusat positif, terutamanya jika logam.
Oleh itu, Aquocomplejos yang terkenal, M (OH2)n. Sebagai n = 6 dalam imej, enam molekul berorientasikan sekitar m dalam octahedron koordinasi (sfera dalaman penghidratan). Bergantung pada saiz m+, Besarnya bebannya, dan ketersediaan elektroniknya, berkata sfera boleh menjadi lebih kecil atau lebih besar.
Boleh melayani anda: Chrome Oxide (III): Struktur, Tatanama, Hartanah, KegunaanAir mungkin pelarut yang paling mengejutkan dari semua: ia melarutkan jumlah larutan yang tidak dapat diukur, ia adalah pelarut terlalu kutub dan mempunyai pemalar dielektrik yang luar biasa tinggi (78.5 k).
Contoh Solverasi
Berikut adalah tiga contoh solvation di dalam air.
Kalsium klorida
Apabila membubarkan kalsium klorida di dalam air, haba dilepaskan apabila kation CA diselesaikan2+ dan cl anion-. Ca2+ Ia dikelilingi oleh sejumlah molekul air yang sama dengan atau lebih besar daripada enam (ca2+-Oh2).
Juga, CL- Ia dikelilingi oleh atom hidrogen, rantau δ+ air (Cl--H2Sama ada). Haba yang dikeluarkan boleh digunakan untuk mencairkan jisim ais.
Urea
Dalam kes urea, ia adalah molekul organik dengan struktur h2N-co-nh2. Semasa menyelesaikan, m molekul2O Bentuk jambatan hidrogen dengan dua kumpulan aming (-NH2-Oh2) dan dengan kumpulan karbonil (c = o- h2Sama ada). Interaksi ini bertanggungjawab untuk kelarutan yang hebat di dalam air.
Juga pembubarannya adalah endotermik, iaitu, ia menyejukkan bekas air di mana ia ditambah.
Ammonium nitrat
Ammonium nitrat, seperti urea, adalah larut yang menyejukkan pembubaran selepas solvation ionnya. NH4+ Solvata sama dengan ca2+, Walaupun mungkin kerana ia adalah geometri tetrahedral mempunyai kurang h molekul2Atau di sekelilingnya; Dan tidak3- Solvata dengan cara yang sama seperti cl anion- (Oh2-Sama ada2No- h2Sama ada).
Rujukan
- Whitten, Davis, Peck & Stanley. Kimia. (8th ed.). Pembelajaran Cengage.
- Belford r. (s.F.). Proses solvation. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Guppy Surf. (s.F.). Proses solvation. Diperolehi dari: Surfgupy.com

