Penyelesaian tak tepu
- 2018
- 314
- Ismael Turner
 Dalam penyelesaian tak tepu, separuh pelarut masih dapat membubarkan lebih banyak larutan
Dalam penyelesaian tak tepu, separuh pelarut masih dapat membubarkan lebih banyak larutan Apakah penyelesaian tak tepu?
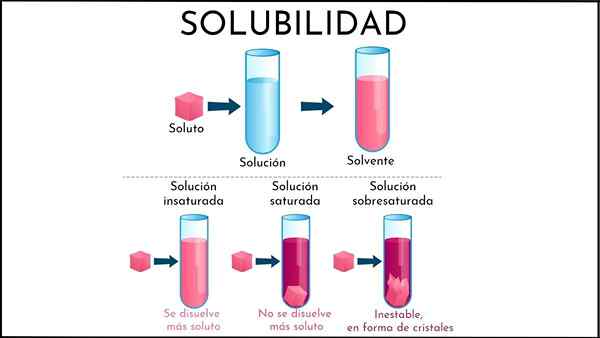
A penyelesaian tak tepu Itu semua penyelesaian di mana medium pelarut masih dapat membubarkan lebih banyak larutan. Medium ini biasanya cair, walaupun ia juga boleh menjadi gas. Mengenai larutan, ia adalah konglomerat zarah pepejal atau gas.
Dan bagaimana dengan larutan cecair? Dalam hal ini, penyelesaiannya homogen selagi kedua -dua cecair boleh dilaraskan. Contohnya ialah penambahan alkohol etil ke air; Dua cecair dengan molekul mereka, CHO3Ch2Oh dan h2Atau, mereka boleh dilarutkan kerana mereka membentuk jambatan hidrogen (pilih3Ch2Oh oh2).
Walau bagaimanapun, jika dicloromethane bercampur (pilih2Cl2) dan air, ini akan membentuk penyelesaian dengan dua fasa: satu berair dan organik yang lain. Ini kerana choles of ch2Cl2 dan h2Atau berinteraksi dengan sangat lemah, jadi beberapa slaid ke atas yang lain, mengakibatkan dua cecair yang tidak dapat dilepaskan.
Setitik minimum cho2Cl2 (larut) cukup untuk menenun air (pelarut). Jika, sebaliknya, mereka boleh membentuk penyelesaian tak tepu, penyelesaian homogen sepenuhnya akan dilihat.
Atas sebab ini, hanya larutan pepejal dan gas dapat menjana penyelesaian tak tepu.
Apakah penyelesaian tak tepu?
Dalam larutan tak tepu, molekul pelarut berinteraksi dengan keberkesanan sehingga molekul larut tidak dapat membentuk fasa lain.
Ini bermakna interaksi pelarut-pelarut melebihi, memandangkan keadaan tekanan dan suhu, interaksi solute-solute.
Setelah interaksi larut-solut meningkat, mereka "mengatur" pembentukan fasa kedua. Sebagai contoh, jika medium pelarut adalah cecair, dan larutan pepejal, yang kedua akan dibubarkan pada yang pertama untuk membentuk penyelesaian homogen, sehingga fasa pepejal muncul, yang tidak lebih dari pelarut yang dicetuskan.
Ia boleh melayani anda: polymethylmetacrylatePrecipitate ini disebabkan oleh fakta bahawa molekul larut berjaya dikelompokkan oleh sifat kimia mereka, intrinsik ke struktur atau pautan mereka. Apabila ini berlaku, dikatakan bahawa penyelesaiannya tepu dengan larut.
Oleh itu, larutan larut tak tepu terdiri daripada fasa cair tanpa mendakan. Walaupun jika larutan itu gas, maka penyelesaian tak tepu mesti bebas dari kehadiran gelembung (yang tidak lebih dari sekumpulan minuman ringan).
Kesan suhu
Suhu secara langsung mempengaruhi tahap ketidakpatuhan penyelesaian berkenaan dengan larut.
Ini boleh disebabkan terutamanya oleh dua sebab: kelemahan interaksi solute-solute akibat kesan haba, dan peningkatan getaran molekul yang membantu menyuraikan molekul larut.
Jika medium pelarut dianggap sebagai ruang padat di mana lubang -lubang molekul larut ditempatkan, suhu meningkatkan molekul akan bergetar meningkatkan saiz lubang -lubang ini; sedemikian rupa sehingga larut dapat membuat jalan ke arah lain.
Pepejal tidak larut
Walau bagaimanapun, sesetengah larutan mempunyai interaksi yang kuat, bahawa molekul pelarut hampir tidak mampu memisahkannya.
Apabila ini begitu, kepekatan minimum larutan terlarut tersebut mencukupi untuk mendakan, dan kemudian ia adalah pepejal yang tidak larut.
Pepejal yang tidak larut, dengan membentuk fasa pepejal kedua yang berbeza dari fasa cecair, menghasilkan beberapa penyelesaian tak tepu.
Sebagai contoh, jika 1L cecair A boleh membubarkan hanya 1g b tanpa prokit, maka apabila mencampurkan 1L A dengan 0.5 g of b akan menjana penyelesaian tak tepu.
Ia dapat melayani anda: HydrocoloidBegitu juga, pangkat kepekatan antara 0 dan 1g b juga membentuk penyelesaian tak tepu. Tetapi selepas 1g, b akan mendakan. Apabila ini berlaku, penyelesaiannya berlaku dari tidak tepu hingga tepu dari b.
Sekiranya penyelesaian tepu dengan 1 dikemukakan kepada pemanasan.5g B, haba akan membantu pembubaran mendakan. Walau bagaimanapun, jika terdapat banyak B yang dicetuskan, haba tidak dapat membubarkannya.
Jika ya, peningkatan suhu hanya akan menguap pelarut atau cecair ke.
Contoh penyelesaian tak tepu
Contoh penyelesaian tak tepu banyak, kerana ia bergantung kepada pelarut dan larut. Sebagai contoh, untuk cecair yang sama A, dan larutan lain c, d, e ... z, penyelesaian mereka akan tidak tepu selagi mereka tidak mendakan atau membentuk gelembung (jika mereka adalah larutan gas).
-Laut dapat menyumbang dua contoh. Air laut adalah penyelesaian penyelamatan besar -besaran. Sekiranya anda mendidih sedikit air ini, akan diperhatikan bahawa ia tidak tepu tanpa adanya garam yang dicetuskan. Walau bagaimanapun, apabila air menguap, ion yang dibubarkan mula dikumpulkan, meninggalkan garam yang tersangkut ke periuk.
-Contoh lain ialah pembubaran oksigen di lautan air. Molekul o2 Frank kedalaman laut yang cukup untuk menghirup fauna marin, walaupun sedikit larut.
Atas sebab ini, adalah perkara biasa untuk memerhatikan gelembung oksigen yang muncul ke permukaan; yang mana, beberapa molekul berjaya dibubarkan.
Keadaan yang sama berlaku dengan molekul karbon dioksida, CO2. Tidak seperti o2, Co2 Ia sedikit lebih larut kerana ia bertindak balas dengan air untuk membentuk asid karbonik, h2Co3.
Boleh melayani anda: Sistem BahanPerbezaan dengan penyelesaian tepu
Meringkaskan yang baru dijelaskan, apakah perbezaan antara penyelesaian yang tidak tepu dan tepu? Pertama, aspek visual: penyelesaian tak tepu terdiri daripada fasa tunggal. Oleh itu, tidak ada kehadiran pepejal (fasa pepejal) atau gelembung (fasa soda).
Juga, kepekatan larut dalam larutan tak tepu boleh berubah sehingga endapan atau gelembung terbentuk. Walaupun dalam larutan biphasic tepu (cecair-padat atau cecair-gas), kepekatan larutan terlarut adalah malar.
Kerana? Kerana zarah -zarah (molekul atau ion) yang membentuk endapan, mewujudkan keseimbangan dengan orang -orang yang dibubarkan dalam pelarut:
Zarah zarah terlarut
Molekul gelembung molekul dibubarkan
Senario ini tidak dipertimbangkan dalam penyelesaian tak tepu. Apabila cuba membubarkan lebih banyak larutan dalam larutan tepu, baki bergerak ke kiri; ke pembentukan lebih mendakan atau gelembung.
Kerana dalam penyelesaian tak tepu ini baki (ketepuan) belum ditubuhkan (ketepuan) dapat "menyimpan" lebih padat atau gas.
Sekitar alga di dasar laut terdapat oksigen terlarut, tetapi apabila gelembung oksigen dilahirkan dari daunnya, ini bermakna ketepuan gas berlaku; Jika tidak, gelembung tidak akan diperhatikan.
Rujukan
- Kimia Am. bahan pengajaran. Lima: Universiti Katolik Pontifical Peru. Pulih dari: Korintus.Pucp.Edu.PE
- Helmestine, Anne Marie, Ph.D. (2018). Definisi penyelesaian tak tepu. Pulih dari: Thoughtco.com
- Tutorvista (s.F.). Penyelesaian tak tepu. Diambil dari: Kimia.Tutorvista.com
- Kimia Librettexts (s.F.). Jenis ketepuan. Pulih dari: chem.Libretxts.org
- Nadine James. (2018). Penyelesaian Tanpa tepu: Definisi & contoh. Pulih dari: belajar.com

