Buteno

- 782
- 207
- Horace Gulgowski
 Struktur Kimia Buutene
Struktur Kimia Buutene Apa itu Buteno?
Dia Buteno Ia adalah nama yang menerima satu siri empat isomer dengan formula kimia c4H8. Mereka adalah alkena atau olefin, iaitu, mereka mempunyai ikatan ganda c = c dalam struktur mereka. Di samping itu, mereka adalah hidrokarbon, yang boleh didapati dalam deposit minyak atau berasal dari retak haba dan mendapatkan produk berat molekul yang lebih rendah.
Empat isomer bertindak balas dengan oksigen melepaskan haba dan api kuning. Mereka juga boleh bertindak balas dengan spektrum luas molekul kecil yang ditambah kepada ikatan berganda mereka.
Tetapi apakah isomer Buteno? Dalam imej atas, struktur dengan sfera putih (hidrogen) dan hitam (karbon) diwakili untuk 1-butena. 1-butena adalah isomer paling mudah hidrokarbon c4H8.
Perhatikan bahawa terdapat lapan sfera putih dan empat sfera hitam, yang bersetuju dengan formula kimia.
Tiga isomer yang lain adalah cis dan trans 2-butena, dan iso-butena. Kesemua mereka mempamerkan sifat kimia yang sangat serupa, walaupun struktur mereka menyebabkan variasi sifat fizikal (titik gabungan dan mendidih, kepadatan, dll.).
Juga, spektrum mereka IR mempunyai corak penyerapan yang serupa.
Colloquially, 1-butena dinamakan sebagai Buteno, walaupun 1-butena hanya merujuk kepada isomer tunggal dan bukan nama generik. Empat sebatian organik ini adalah gas, tetapi boleh dicairkan untuk tekanan tinggi atau memeluk.
Mereka adalah sumber haba dan tenaga, reagen untuk sintesis sebatian organik lain dan, di atas semua, perlu untuk pembuatan getah buatan selepas sintesis butadiena.
Ciri -ciri fizikal dan kimia Buteno
Berat molekul
56.106 g/mol. Berat ini sama untuk semua isomer formula c4H8.
Aspek fizikal
Ia adalah gas yang tidak berwarna dan mudah terbakar (seperti isomer lain), dan mempunyai bau yang agak aromatik.
Takat didih
Titik mendidih untuk isomer Buteno adalah seperti berikut:
1 -butene: -6º c
CIS-2-BUTENE: 3.Ke -7 c
Trans-2-Butene: 0.96º c
2 -Methylpropene: -6.9º c
Takat lebur
1 -butene: -185.3 c
CIS-2-BUTENE: -138.9º c
Trans-2-Butene: -105.5 c
2 -Methylpropeno: -140.4 c
Kelarutan
Buteno sangat tidak larut dalam air kerana sifat apolarnya. Walau bagaimanapun, ia larut dengan sempurna dalam beberapa alkohol, seperti benzena, toluena dan ether.
Ketumpatan
0.577 hingga 25º C. Oleh itu, ia kurang padat daripada air dan dalam bekas ia akan terletak di atas yang sama.
Reaktiviti
Seperti mana -mana alkena, ikatan gandanya terdedah untuk menambahkan molekul atau pengoksidaan. Ini menjadikan buteno dan isomernya reaktif. Sebaliknya, mereka adalah bahan mudah terbakar, jadi sebelum suhu lebihan mereka bertindak balas dengan oksigen udara.
Boleh melayani anda: butanal: struktur, sifat, kegunaan dan risikoStruktur Kimia Buutene
Di bahagian atas, struktur 1-butena diwakili. Ke kiri anda, anda dapat melihat lokasi ikatan berganda antara karbon pertama dan kedua.
Molekul mempunyai struktur linear, walaupun rantau di sekitar pautan c = c adalah rata disebabkan oleh hibridisasi SP2 daripada karbon ini.
Sekiranya molekul 1-butena dihidupkan pada sudut 180º, molekul yang sama tidak akan mempunyai perubahan yang jelas, oleh itu, ia tidak mempunyai aktiviti optik.
Bagaimana molekul anda berinteraksi? Pautan C-H, C dan C-C adalah sifat apolar, jadi tidak seorang pun daripada mereka bekerjasama dalam pembentukan momen dipole.
Akibatnya, molekul CHO2= Chch2Ch3 Mereka mesti berinteraksi melalui kuasa penyebaran London.
Hujung kanan Butene membentuk dipole segera, yang pada jarak dekat memolarisasi atom bersebelahan molekul jiran. Sebaliknya, hujung kiri pautan c = c, berinteraksi bertindih awan π di atas yang lain (seperti dua wafer atau lembaran).
Kerana terdapat empat atom karbon yang mengarang rangka molekul, interaksinya tidak cukup untuk fasa cecair untuk mempunyai titik mendidih -6º c.
Isomer perlembagaan dan geometri
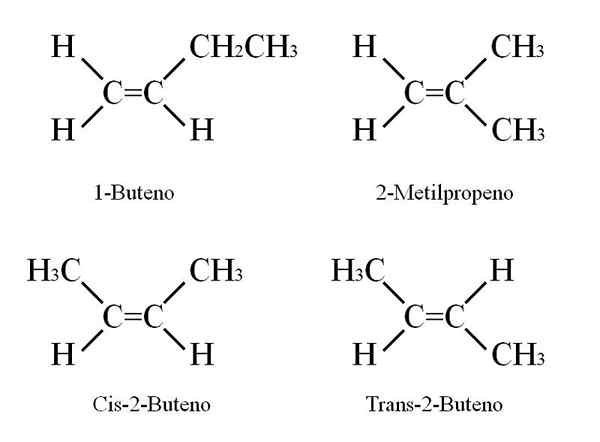 Struktur butenous. Sumber: Gabriel Bolívar
Struktur butenous. Sumber: Gabriel Bolívar 1-butena mempunyai formula molekul c4H8; Walau bagaimanapun, sebatian lain mungkin ada dalam struktur mereka dengan bahagian atom C dan H yang sama.
Bagaimana mungkin? Sekiranya struktur 1-butena diperhatikan dengan teliti, substituen karbon c = c boleh ditukar. Pertukaran ini menghasilkan sebatian lain dari kerangka yang sama.
Di samping itu, kedudukan ikatan berganda antara C-1 dan C-2 boleh bergerak ke arah C-2 dan C-3: CH3CH = Chch3, 2-butena.
Dalam 2-butena, atom H boleh diletakkan di sisi yang sama ikatan ganda, yang sepadan dengan stereoisomer CIS; atau dalam orientasi spatial yang bertentangan, dalam stereoisomer trans. Kedua -duanya merupakan apa yang juga dikenali sebagai isomer geometri. Perkara yang sama berlaku untuk kumpulan -ch3.
Begitu juga, ambil perhatian bahawa jika ditinggalkan dalam molekul Cho3CH = Chch3 Atom H di satu sisi, dan kumpulan CH3 Di lain, isomer perlembagaan akan diperolehi: CH2= C (ch3)2, 2-methylpropene (juga dikenali sebagai iso-butena).
Boleh melayani anda: kalium nitrat (kNO3)Empat sebatian ini mempunyai formula yang sama c4H8 Tetapi struktur yang berbeza. 1-butena dan 2-methylpropene adalah isomer perlembagaan; dan cis dan trans-2-butena, isomer geometri di antara mereka dua (dan perlembagaan berkenaan dengan selebihnya).
Kestabilan
Haba pembakaran
Dari imej atas, yang mana dari empat isomer mewakili struktur yang paling stabil? Jawapannya dapat dijumpai, sebagai contoh, dalam pemanasan pembakaran masing -masing.
Apabila bertindak balas dengan oksigen, isomer dengan formula c4H8 berubah menjadi co2 melepaskan air dan panas:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
Pembakaran adalah eksotermik, jadi lebih banyak haba dilepaskan, lebih tidak stabil adalah hidrokarbon. Oleh itu, dari empat isomer yang melepaskan kurang haba untuk dibakar di udara, akan menjadi yang paling stabil.
Pembakaran memanaskan untuk empat isomer adalah:
-1-butena: 2717 kJ/mol
-CIS-2-Butene: 2710 kJ/mol
-Trans-2-Butene: 2707 kJ/mol
-2-methylpropeno: 2700 kJ/mol
Perhatikan bahawa 2-methylpropene adalah isomer yang mengeluarkan kurang panas. Manakala 1-butena adalah yang melepaskan haba yang paling panas, yang diterjemahkan ke dalam ketidakstabilan yang lebih besar.
Kesan sterik dan elektronik
Perbezaan kestabilan ini antara isomer boleh ditolak terus dari struktur kimia.
Menurut Alkenes, orang yang memiliki substituen yang paling banyak memperoleh penstabilan yang lebih besar dari ikatan gandanya. Oleh itu, 1-butena adalah yang paling tidak stabil kerana ia hampir tidak mempunyai substituen (-ch2Ch3); iaitu, ia adalah monosustUido (rhc = cho2).
Isomer cis dan trans dari 2-butena berbeza dalam tenaga kerana voltan dinding van der berasal dari kesan sterik.
Di isomer cis, kedua -dua kumpulan ch3 Di sisi yang sama ikatan berganda mereka menangkis satu sama lain, sementara di dalam isomer trans, ini cukup jauh dari satu sama lain.
Tetapi mengapa kemudian 2-methylpropene adalah isomer yang paling stabil? Kerana kesan elektronik memberi syafaat.
Dalam kes ini, walaupun ia adalah alkena yang dibubarkan, kedua -dua kumpulan CH3 Mereka berada dalam karbon yang sama; dalam kedudukan permata mengenai yang lain.
Kumpulan -kumpulan ini menstabilkan karbon ikatan berganda yang memberikannya sebahagian daripada awan elektronik mereka (kerana ia agak lebih berasid dengan mempunyai hibridisasi SP2).
Di samping itu, dalam 2-butena dua isomernya hanya mempunyai karbon ke-2; Walaupun 2-methylpropene mengandungi karbon ke-3, kestabilan elektronik yang lebih besar.
Boleh melayani anda: Struktur Bahan: Konsep dan ContohnyaKuasa intermolecular
Kestabilan empat isomer mengikuti urutan logik, tetapi yang sama tidak berlaku dengan daya intermolecular. Sekiranya titik lebur dan mendidih mereka dibandingkan, mereka akan mendapati bahawa mereka tidak mematuhi perintah yang sama.
Diharapkan bahawa trans-2-butena akan membentangkan daya intermolecular terbesar kerana mempunyai hubungan permukaan yang lebih besar antara dua molekul, tidak seperti cis-2-butena, yang kerangka menarik C. Walau bagaimanapun, cis-2-butena mendidih pada suhu yang lebih tinggi (3.7 c), bahawa isomer trans (0.96º c).
Titik mendidih yang sama untuk 1-butena dan 2-methylpropene akan mengharapkan mereka kerana mereka berstruktur sangat serupa. Walau bagaimanapun, dalam keadaan pepejal perbezaan berubah secara radikal. 1 -butene cair hingga -185.3º C, manakala 2 -methylpropene pada -140.4 c.
Di samping itu, isomer cis-2-butena mencairkan ke -138.9º C, pada suhu yang sangat dekat dengan 2-methylpropene, yang boleh bermakna bahawa dalam pepejal mereka mempunyai susunan yang sama stabil.
Dari data ini dapat disimpulkan bahawa, walaupun mengetahui struktur yang paling stabil, mereka tidak memberikan cahaya yang cukup dalam pengetahuan tentang bagaimana daya intermolecular beroperasi dalam cecair; Dan lebih -lebih lagi, dalam fasa pepejal isomer ini.
Butenus menggunakan
-Butenians, memandangkan panas pembakaran mereka, hanya boleh digunakan sebagai sumber haba atau bahan bakar. Oleh itu, diharapkan api 1-butena panas lebih banyak daripada isomer yang lain.
-Mereka boleh digunakan sebagai pelarut organik.
-Mereka berfungsi sebagai bahan tambahan untuk meningkatkan tahap oktana petrol.
-Dalam sintesis organik, 1-butena mengambil bahagian dalam pengeluaran sebatian lain seperti: butylene oxide, 2-glutanol, succinimida dan terbutilmecaptano (digunakan untuk memberikan gas dapurnya).
Juga, dari isomer butene anda boleh mendapatkan butadieno (cho2= Ch-ch = ch2), di mana getah tiruan disintesis.
Di luar sintesis ini, kepelbagaian produk akan bergantung kepada molekul yang ditambah kepada ikatan berganda.
Sebagai contoh, alkil halida boleh disintesis jika mereka bertindak balas dengan halogen; alkohol, jika mereka menambah air dalam medium berasid; dan butang ketiga jika mereka menambah alkohol berat molekul rendah (seperti metanol).
Rujukan
- Francis a. Tortoiseshell. Kimia organik. Asid karboksilat (edisi keenam, halaman 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Diambil dari: ia adalah.Wikipedia.org
- YPF (Julai). Butenians. [Pdf]. Diambil dari: ypf.com
- William Reusch (2013). Tambahan reaksi alkes. Pulih dari: 2.Kimia.MSU.Edu
- PubChem (2018). 1-butena. Pulih dari: pubchem.NCBI.NLM.NIH.Gov

