Komponen penyelesaian isotonik, penyediaan, contoh
- 1936
- 250
- Ms. Edgar Carroll
A penyelesaian isotonik Ia adalah salah satu yang membentangkan kepekatan larut yang sama berkenaan dengan penyelesaian yang dipisahkan atau diasingkan oleh pepijat semiperman. Halangan ini membolehkan pelarut menjadi Transte, tetapi tidak semua zarah larut.
Dalam fisiologi, penyelesaian terpencil ini merujuk kepada cecair intrasel, iaitu, bahagian dalam sel; Walaupun penghalang semipermeable sepadan dengan membran sel, dibentuk oleh lipid bilay.
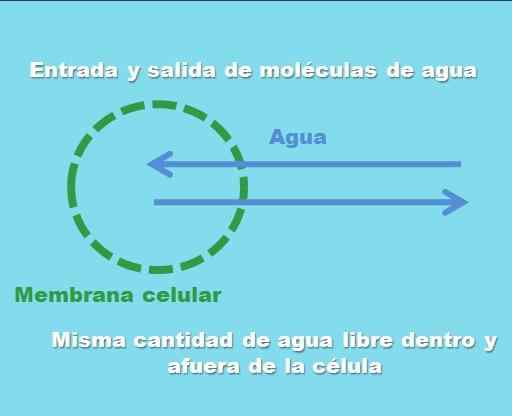
 Interaksi sel dengan penyelesaian isotonik. Sumber: Gabriel Bolívar.
Interaksi sel dengan penyelesaian isotonik. Sumber: Gabriel Bolívar. Imej unggul menggambarkan apa yang dimaksudkan dengan penyelesaian isotonik. "Kepekatan" air adalah sama di dalam dan di luar sel, jadi molekul mereka masuk atau keluar melalui membran sel dengan frekuensi yang sama. Oleh itu, jika dua molekul air memasuki sel, dua daripadanya akan meninggalkan serentak ke arah medium ekstraselular.
Keadaan ini, yang dipanggil isotonicity, hanya berlaku apabila medium berair, di dalam dan di luar sel, mengandungi bilangan zarah larut larut yang sama. Oleh itu, penyelesaiannya akan menjadi isotonik jika kepekatan larutannya sama dengan medium bendalir atau intraselular. Contohnya, penyelesaian garam 0.9% adalah isotonik.
[TOC]
Komponen penyelesaian isotonik
Untuk menjadi penyelesaian isotonik, terlebih dahulu mesti memastikan osmosis berlaku dalam larutan atau pelarut. Ini hanya mungkin jika penghalang semipermeable hadir, yang membolehkan molekul pelarut memindahkannya, tetapi bukannya larut, terutamanya larutan elektrik, ion.
Oleh itu, larutan tidak dapat disebarkan dari kawasan yang lebih pekat ke kawasan yang lebih cair. Sebaliknya, ia akan menjadi molekul air yang akan bergerak dari satu tempat ke tempat lain, menyeberangi penghalang semiperman, dan mengambil osmosis. Dalam sistem akueus dan biologi, penghalang ini adalah kecemerlangan sel membran sel.
Boleh melayani anda: persaingan (biologi): ciri, jenis, contohMempunyai penghalang semipermeable dan medium pelarut, kehadiran ion terlarut atau garam di kedua -dua media juga perlu: dalaman (di dalam halangan), dan luaran (di luar halangan).
Sekiranya kepekatan ion ini sama di kedua -dua belah pihak, maka tidak akan ada kelebihan atau defisit molekul air untuk menyelesaikannya. Iaitu bilangan molekul bebas air adalah sama, dan oleh itu, mereka tidak akan memindahkan penghalang semipermeable di mana sahaja dengan tujuan memadankan kepekatan ion.
Penyediaan
- Syarat dan persamaan
Walaupun penyelesaian isotonik dapat disediakan dengan pelarut, kerana air adalah medium sel, ini dianggap sebagai pilihan kegemaran. Mengetahui dengan tepat kepekatan garam dalam badan tertentu badan, atau di dalam aliran darah, adalah mungkin untuk menganggarkan berapa banyak garam yang mesti dibubarkan dalam jumlah tertentu.
Dalam organisma vertebrata diterima, secara purata, kepekatan larutan dalam plasma darah adalah sekitar 300 mOSM/L (miliosmolariti), dapat menafsirkan hampir seperti 300 mmol/l. Iaitu, ia adalah kepekatan yang sangat dicairkan. Untuk menganggarkan miliosmolariti, persamaan berikut mesti digunakan:
Osmolarity = m · v · g
Untuk tujuan praktikal diandaikan bahawa g, Pekali osmotik, mempunyai nilai 1. Supaya persamaannya sekarang seperti:
Osmolarity = m · v
Di mana m Ia adalah molariti larut, dan v Bilangan zarah di mana kata larut dissociates di dalam air. Kemudian, kami membiak nilai ini dengan 1.000 untuk mendapatkan miliosmolariti untuk larutan tertentu.
Boleh melayani anda: Apa itu homoplasia? (Dengan contoh)Sekiranya terdapat lebih daripada satu larutan, jumlah miliosolariti penyelesaiannya akan menjadi jumlah ribuan orang untuk setiap larut. Lebih larut berkenaan dengan bahagian dalam sel, kurang isotonik akan menjadi penyelesaian yang disediakan.
- Contoh penyediaan
Katakan anda ingin menyediakan satu liter penyelesaian isotonik berdasarkan glukosa dan natrium diácid fosfat. Berapa banyak yang perlu ditimbang glukosa? Menganggap bahawa 15 gram nah akan digunakan2PO4.
Langkah pertama
Kita mesti terlebih dahulu menentukan osmolariti nah2PO4 mengira molaritasnya. Untuk melakukan ini, kita beralih kepada jisim molar atau berat molekulnya, 120 g/mol. Kerana kita diminta untuk satu liter penyelesaian, kita menentukan tahi lalat dan kita akan secara langsung mempunyai molaritas:
Moles (nah2PO4) = 15 g ÷ 120g/mol
= 0.125 mol
M (nah2PO4) = 0.125 mol/l
Tetapi ketika nah2PO4 Ia larut dalam air, mengeluarkan kation+ dan anion h2PO4-, Oleh itu v Ia mempunyai nilai 2 dalam persamaan osmolariti. Kami terus mengira kemudian untuk nah2PO4:
Osmolarity = m · v
= 0.125 mol/l · 2
= 0.25 OSM/L
Dan dengan mengalikannya dengan 1.000 kita mempunyai miliosmolariti nah2PO4:
0.25 OSM/L · 1.000 = 250 mosm/l
Langkah kedua
Oleh kerana jumlah miliosolariti penyelesaian mestilah sama dengan 300 mosm/L, kita tolak untuk mengetahui apa yang harus glukosa:
MOSM/L (Glukosa) = MOSM/L (Jumlah) - MOSM/L (NAH2PO4)
= 300 mosm/l - 250 mosm/l
= 50 mosm/l
Kerana glukosa tidak berpecah, v Vale 1 dan osmolaritasnya sama dengan molaritasnya:
M (glukosa) = 50 mosm/l ÷ 1.000
= 0.05 mol/l
Menjadi molar glukosa 180 g/mol, akhirnya kita menentukan berapa banyak gram yang kita mesti menimbang untuk membubarkannya dalam liter penyelesaian isotonik:
Boleh melayani anda: Renina: Struktur, pengeluaran, rembesan, fungsiJisim (glukosa) = 0.05 mol · 180 g/mol
= 9 g
Oleh itu, penyelesaian nah isotonik ini2PO4/Glukosa menyediakan 15 gram nah2PO4 dan 9 gram glukosa dalam satu liter air.
Contoh penyelesaian isotonik
Penyelesaian atau cecair isotonik tidak menyebabkan kecerunan atau perubahan kepekatan ion dalam badan, jadi tindakan mereka pada dasarnya memberi tumpuan kepada pesakit menghidrat yang menerimanya sekiranya pendarahan atau dehidrasi.
Saline biasa
Salah satu penyelesaian ini adalah garam biasa, dengan kepekatan NaCl 0.9%.
Penyelesaian Laktat Ringer
Penyelesaian isotonik lain yang digunakan untuk tujuan yang sama adalah laktat ringer, yang mengurangkan keasidan disebabkan oleh penampan atau komposisi redamannya, dan penyelesaian fosfat Sorensen, yang terdiri daripada fosfat dan natrium klorida.
Sistem bukan queous
Isotonicity juga boleh digunakan untuk sistem yang tidak berahi, seperti di mana pelarut adalah alkohol; Selagi, terdapat halangan semipermeable yang memihak kepada ketelusan molekul alkohol dan mengekalkan zarah larut.
Rujukan
- Dari lehr spilva, ke. Dan Muktans, dan. (1999). Panduan Kepakaran Farmaseutikal di Venezuela. Edisi xxxvª. Edisi global.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Elsevier b.V. (2020). Penyelesaian isotonik. Diperoleh dari: Scientedirect.com
- Adrienne Brundage. (2020). Penyelesaian Isotonik: Definisi & Contohnya. Kajian. Pulih dari: belajar.com
- Felicitas Merino de la Hoz. (s.F.). Seroterapi intravena. Universiti Cantabria. [Pdf]. Pulih dari: ocw.Unican.adalah
- Makmal farmaseutik dan pengkompaunan. (2020). Persiapan Ophthalmic: Buffer Isotonik. Pulih dari: farmlabs.Unc.Edu

