Ester
- 1963
- 162
- Clarence Greenholt DDS
 Ester adalah sebatian organik yang mempunyai komponen asid karboksilik dan alkohol lain
Ester adalah sebatian organik yang mempunyai komponen asid karboksilik dan alkohol lain Apa itu ester?
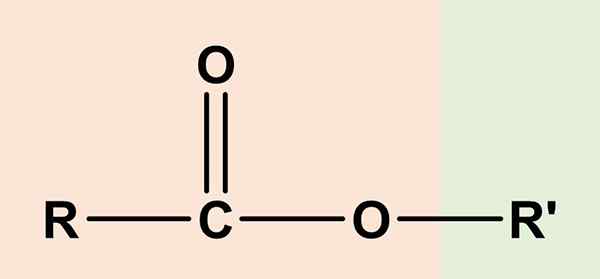
The ester Mereka adalah sebatian organik yang mempunyai komponen asid karboksilik dan alkohol yang lain. Formula kimia umumnya ialah RCO2R' atau rcoor'. Bahagian kanan, RCOO, sepadan dengan kumpulan karboksil, manakala kanan, atau' Ia adalah alkohol. Kedua -dua berkongsi atom oksigen dan berkongsi persamaan tertentu dengan Ethers (ROR ').
Atas sebab ini asetat etil, CH3Cooch2Ch3, Yang paling mudah ester, dianggap sebagai Eter aset atau cuka asid, Dan dari situ asal etimologi nama 'ester'. Jadi ester terdiri daripada penggantian hidrogen berasid kumpulan COOH, dengan sewa alkohol dari alkohol.
Di mana ester?
Dari tanah kimia organik, terdapat banyak sumber semula jadi. Bau buah -buahan yang menyenangkan, seperti pisang, pir dan epal, adalah hasil interaksi ester dengan banyak komponen lain. Mereka juga terdapat dalam bentuk trigliserida dalam minyak atau lemak.
Tubuh kita mengeluarkan trigliserida dari asid lemak, yang mempunyai rantai berkarbonat yang panjang, dan alkohol gliserol. Apa yang membezakan beberapa ester dari orang lain terletak di r, rantaian komponen asid, seperti dalam r ', komponen alkohol.
Ester berat molekul yang rendah mesti mempunyai sedikit karbon dalam R dan R ', manakala yang lain, seperti lilin, mempunyai banyak karbon terutamanya dalam R', komponen alkohol, dan oleh itu berat molekul yang tinggi.
Walau bagaimanapun, tidak semua ester adalah organik yang ketat. Jika kumpulan kumpulan karbonhel kumpulan karbonil digantikan oleh salah satu fosforus, maka rpoor akan '. Ini dikenali sebagai ester fosfat, dan sangat penting dalam struktur DNA.
Oleh itu, apabila atom boleh dikaitkan dengan cekap ke karbon atau oksigen, seperti sulfur (rsoor '), ia dapat membentuk ester bukan organik.
Estres Properties
Ester bukan asid atau alkohol, jadi mereka tidak berkelakuan seperti itu. Sebagai contoh, titik lebur dan mendidihnya lebih rendah daripada yang mempunyai berat molekul yang sama, tetapi lebih dekat dengan nilai -nilai kepada aldehid dan keton.
Asid butanoik, CHO3Ch2Ch2COOH, mempunyai titik mendidih 164º C, manakala etil asetat, CH3Cooch2Ch3, daripada 77.1st c.
Selain daripada contoh baru-baru ini, titik mendidih 2-methylbutane3CH (Ch3) Ch2Ch3, Metil asetat, CHO3Cooch3, dan 2-butanol, Cho3,Ch (oh) ch2Ch3, Mereka adalah seperti berikut: 28, 57 dan 99º C. Tiga sebatian mempunyai berat molekul 72 dan 74 g/mol.
Ester peso molekul rendah cenderung tidak menentu dan mempunyai bau yang menyenangkan, itulah sebabnya kandungan mereka dalam buah -buahan memberi mereka wangian keluarga mereka. Sebaliknya, apabila berat molekul mereka tinggi, mereka adalah pepejal kristal yang tidak berwarna dan tidak berbau, atau bergantung kepada struktur mereka, mereka dapat mempamerkan ciri -ciri lemak.
Kelarutan air
Asid karboksilik dan alkohol biasanya larut dalam air, kecuali jika mereka mempunyai watak hidrofobik yang tinggi dalam struktur molekul mereka. Perkara yang sama berlaku untuk ester. Apabila R atau R 'adalah rantai pendek, ester boleh berinteraksi dengan molekul air melalui dipole-dipolo dan pasukan pasukan London.
Boleh melayani anda: Kompaun kimiaIni kerana ester adalah penerima jambatan hidrogen. Sebagai? Untuk dua atom oksigen rcoornya '. Molekul air boleh membentuk jambatan hidrogen dengan mana -mana oksigen ini. Tetapi apabila rantai R atau R sangat panjang, mereka mengusir air di persekitaran mereka, menjadikannya mustahil untuk pembubaran mereka.
Contoh yang jelas ini berlaku dengan ester trigliserid. Rantai sampingan mereka panjang dan membuat minyak dan lemak tidak larut di dalam air, kecuali jika mereka bersentuhan dengan pelarut kutub yang kurang, lebih berkaitan dengan rantai ini.
Tindak balas hidrolisis
Esteres juga boleh bertindak balas dengan molekul air dalam apa yang dikenali sebagai tindak balas hidrolisis. Walau bagaimanapun, mereka memerlukan asid atau persekitaran asas untuk mempromosikan mekanisme tindak balas tersebut:
Rcoor ' + H2Sama ada RCOOh + R'oH
(Separuh berasid)
Molekul air ditambah kepada kumpulan karbonil, c = o. Hidrolisis asid diringkaskan dalam penggantian setiap r 'komponen alkohol oleh OH dari air. Perhatikan juga bagaimana ester "pecah" dalam dua komponennya: asid karboksilik, rcooh dan alkohol r'oh.
Rcoor ' + Oh- => RCOSama ada- + R'oH
(Medium Asas)
Apabila hidrolisis dilakukan dalam medium asas, tindak balas yang tidak dapat dipulihkan berlaku yang dikenali sebagai saponifikasi. Ini sangat digunakan dan merupakan asas dalam penjelasan sabun artisanal atau perindustrian.
RCOO- Ia adalah anion karboksilat, stabil, yang dikaitkan secara elektrostatik dengan kation utama di tengah.
Sekiranya asas yang digunakan adalah NaOH, garam terbentuk. Apabila ester adalah trigliserida, yang secara definisi mempunyai rantai sampingan tiga R, tiga garam asid lemak, rcoone, dan alkohol gliserol terbentuk.
Tindak balas pengurangan
Ester adalah sebatian yang sangat teroksida. Ini bermaksud bahawa ia mempunyai beberapa ikatan kovalen dengan oksigen. Dengan menghapuskan ikatan C-O, rehat berlaku yang akhirnya memisahkan komponen asid dan alkohol; Dan lebih banyak lagi, asid dikurangkan kepada cara yang kurang teroksida, kepada alkohol:
Rcoor '=> rch2OH + R'OH
Ini adalah tindak balas pengurangan. Ejen pengurangan yang kuat diperlukan, seperti litium dan aluminium hidrida, lialh4, dan medium berasid yang menggalakkan penghijrahan elektron. Alkohol adalah bentuk terkecil, iaitu, yang mempunyai ikatan kovalen yang kurang dengan oksigen (hanya satu: c-oh).
Dua alkohol, RCH2Oh + r'oh, berasal dari dua rantaian masing -masing dari ester asal '. Ini adalah kaedah sintesis alkohol yang ditambah nilai dari esternya.
Sebagai contoh, jika anda ingin mengeluarkan alkohol ester eksotik, ini akan menjadi laluan yang baik untuk tujuan itu.
Tindak balas transerifikasi
Ester boleh diubah menjadi orang lain jika mereka bertindak balas ke dalam media berasid atau asas dengan alkohol:
Rcoor ' + R "Oh RCOAtau " + R'oH
Struktur Ester
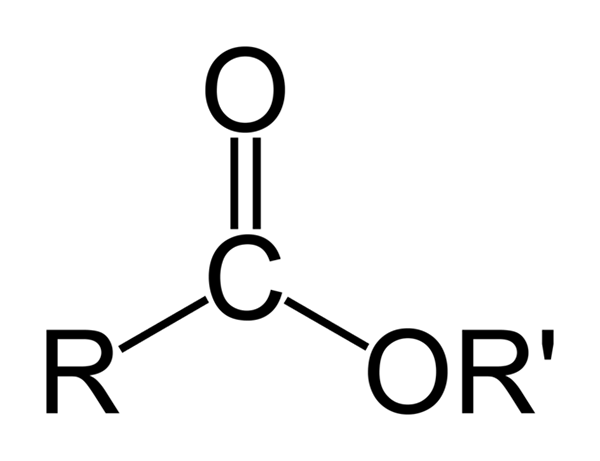 Struktur kimia umum ester organik. Sumber: Ben Mills melalui Wikipedia
Struktur kimia umum ester organik. Sumber: Ben Mills melalui Wikipedia Imej unggul mewakili struktur umum semua ester organik. Perhatikan bahawa r, kumpulan karbonil c = o, dan atau ', membentuk segitiga rata, produk hibridisasi SP2 atom karbon pusat. Walau bagaimanapun, atom lain boleh mengadopsi geometri lain, dan struktur mereka bergantung pada sifat intrinsik R atau R '.
Boleh melayani anda: nitrat: sifat, struktur, tatanama, latihanSekiranya r atau r 'adalah rantai alqulicas yang mudah, contohnya, jenis (pilih2)nCh3, Anda akan melihat zigzagueada di ruang angkasa. Ini adalah kes Pentilo Butanoat3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3.
Tetapi di mana -mana karbon rantai itu cawangan atau tidak tepu boleh didapati (c = c, c≡C), yang akan mengubah struktur global ester. Dan untuk sebab ini sifat fizikalnya, seperti kelarutan dan titik mendidih dan gabungannya, berbeza dengan setiap kompaun.
Sebagai contoh, lemak tak tepu mempunyai pautan berganda dalam rantai R mereka, yang secara negatif mempengaruhi interaksi intermolecular. Akibatnya, titik lebur mereka turun, sehingga mereka cair, atau minyak, pada suhu bilik.
Penerima Jambatan Hidrogen
Walaupun imej rangka ester menonjol lebih banyak, ia adalah rantai r dan r yang bertanggungjawab untuk kepelbagaian dalam struktur mereka.
Walau bagaimanapun, ciri -ciri struktur ester disites ke segitiga: mereka adalah penerima jambatan hidrogen. Sebagai? Oleh oksigen kumpulan karbonil dan alcoxide (-or ').
Ini mempunyai pasangan elektron percuma, yang boleh menarik atom hidrogen sebahagian positif molekul air.
Oleh itu, ia adalah jenis interaksi dipole-dipole khas. Molekul air mendekati ester (jika rantai r 'tidak menghalang dan jambatan dibentuk c = o-h2Atau, atau oh2-O-r '.
Nomenclature of Esters
Untuk menamakan ester dengan sewajarnya, ia perlu. Juga, mana -mana cawangan, substituen atau ketidakpastian yang mungkin.
Sebaik sahaja ini selesai, nama r 'kumpulan alcoxide -or' akhiran ditambah -ilo, Walaupun rantaian kumpulan Carboxilo -oor R, akhiran -ATO. Pertama, Bahagian R disebutkan, diikuti dengan perkataan 'of' dan kemudian nama bahagian r '.
Contohnya, CHO3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3 Ia mempunyai lima karbon di sebelah kanan, iaitu, mereka adalah yang sesuai dengan r '. Dan di sebelah kiri terdapat empat atom karbon (termasuk kumpulan karbonil c = o).
Oleh itu, r 'adalah kumpulan pentil, dan r a butana (kerana termasuk karbonil dan mempertimbangkan rantaian utama). Kemudian, untuk memberi nama kepada kompaun, sudah cukup untuk menambah akhiran yang sepadan dan namakannya dalam urutan yang betul: butanaATO dari Pentilo.
Cara menamakan sebatian berikut: CH3Ch2COOC (Ch3)3? Rantai -c (CHO3)3 sepadan dengan substituen alquilical recto-butil. Oleh kerana sebelah kiri mempunyai tiga karbon, ia adalah "propana". Namanya kemudian: propanaATO daripada tert-tetapiilo.
Bagaimana ester terbentuk?
Esterifikasi
Terdapat banyak laluan untuk mensintesis ester, yang sebahagiannya boleh menjadi novel. Walau bagaimanapun, mereka semua berkumpul dalam fakta bahawa segitiga imej struktur mesti dibentuk, iaitu, pautan co-o. Untuk itu, ia mesti bermula dari sebatian yang sebelum ini mempunyai kumpulan karbonil: sebagai asid karboksilik.
Dan apa yang harus dihubungkan dengan asid karboksilik? Kepada alkohol, jika tidak, ia tidak akan mempunyai komponen alkohol yang mencirikan ester. Walau bagaimanapun, asid karboksilik memerlukan haba dan keasidan untuk membolehkan mekanisme tindak balas diteruskan. Persamaan kimia berikut mewakili perkara di atas:
Boleh melayani anda: aluminium hidrida (ALH3): struktur, sifat, kegunaanRcooh + r'oh rcoor ' + h2Sama ada
(Separuh berasid)
Ini dikenali sebagai esterifikasi.
Sebagai contoh, asid lemak boleh dihubungkan dengan metanol, CHO3Oh, untuk menggantikan asid mereka dengan kumpulan metil, jadi tindak balas ini juga boleh dianggap sebagai metilasi. Ini adalah langkah penting apabila menentukan profil asid lemak minyak atau lemak tertentu.
Ester dari klorida asid
Cara lain untuk mensintesis ester adalah dari acyl chlorides, rcocl. Di dalamnya, bukannya menggantikan kumpulan hidroksil OH, atom CL diganti:
Rcocl + r'oh => rcoor ' + hcl
Dan tidak seperti penanaman asid karboksilik, air tidak dikeluarkan tetapi asid hidroklorik.
Kaedah lain boleh didapati dalam dunia kimia organik, seperti pengoksidaan Baeyer-Villiger, yang menggunakan asid peroksi (RCOOOH).
Estres menggunakan
 Ester digunakan untuk pelbagai perkara, seperti pembuatan lilin
Ester digunakan untuk pelbagai perkara, seperti pembuatan lilin Antara kegunaan utama ester adalah:
- Dalam lilin atau lilin penjelasan, seperti gambar unggul. Untuk tujuan ini, ester rantai sampingan yang sangat panjang digunakan.
- Sebagai pengawet ubat atau makanan. Ini disebabkan oleh tindakan parabens, yang tidak lebih daripada ester asid para-hydroxibenzoic. Walaupun mereka mengekalkan kualiti produk, terdapat kajian yang mempersoalkan kesan positifnya terhadap badan.
- Mereka berkhidmat untuk pembuatan wangian buatan yang meniru bau dan rasa banyak buah -buahan atau bunga. Jadi ester hadir dalam merawat, ais krim, minyak wangi, kosmetik, sabun, syampu, antara produk komersial lain yang merit aroma atau perisa yang menarik.
- Ester juga boleh membekalkan kesan farmakologi positif. Atas sebab ini, industri farmaseutikal telah mendedikasikan dirinya untuk mensintesis ester yang diperoleh daripada asid yang ada di dalam badan untuk menilai peningkatan yang mungkin dalam rawatan penyakit. Aspirin adalah salah satu contoh paling mudah dari ester ini.
- Ester cecair, seperti etil asetat, adalah pelarut yang mencukupi untuk jenis polimer tertentu, seperti nitrocellulose dan pelbagai resin.
Contoh ester
Beberapa contoh ester tambahan adalah seperti berikut:
- Butanato de Pentilo, CH3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3, yang berbau seperti albicoque dan pir.
- Vinyl acetate, CHO3Cooch2= Ch2, dari mana polimer polyvinyl acetate berlaku.
- Isopentilo pentanoato, ch3Ch2Ch2Ch2Cooch2Ch2CH (Ch3)2, yang meniru rasa epal.
- Ethyl Propanoate, CH3Ch2Cooch2Ch3.
- Propyl metanoate, hcooch2Ch2Ch3.
Rujukan
- T.W. Graham Solomons, Craight B. Fryhle. Kimia organik. (Edisi Kesepuluh, p 797-802, 820) Wiley Plus.
- Carey, f. Ke. Kimia Organik (2006) Edisi Keenam. Editorial MC Graw Hill-
- Kimia Librettexts. Nomenclature of Esers. Pulih dari: chem.Libretxts.org
- Admin. (19 September 2015). Esters: sifat kimia, sifat dan kegunaannya. Diambil dari: tulen-kimia.com
- Kimia organik dalam kehidupan seharian kita. (9 Mac 2014). Apakah kegunaan ester? Diperolehi daripada: Gen2Chemistassignment.Weebly.com
- Chemics.Bersih (2018). Contoh ester. Pulih dari: kimia.jaring
- Paz maría de lourdes cornejo arteaga. Aplikasi utama ester. Diambil dari: uaeh.Edu.mx
- Jim Clark. (Januari 2016). Pengenalan ester. Diambil dari: chemguide.co.UK

