Jadual kuantum
- 1296
- 62
- Clarence Greenholt DDS
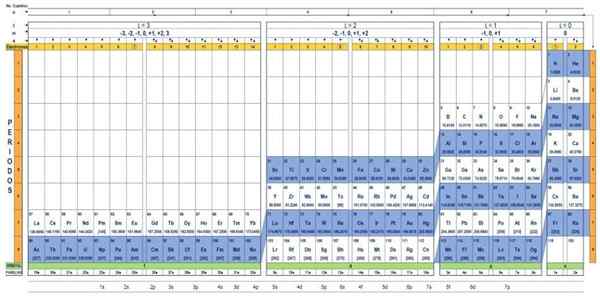
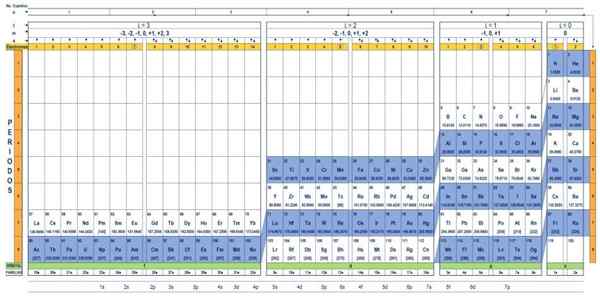 Jadual kuantum unsur -unsur. Sumber: UNAM.
Jadual kuantum unsur -unsur. Sumber: UNAM. Apakah jadual kuantum?
The Jadual kuantum Ini adalah cara untuk mengatur unsur -unsur kimia, yang direka untuk menentukan dengan mudah set nombor kuantum yang mencirikan masing -masing.
Saintis telah mendapati bahawa, dalam sifat semua elemen, ada corak tertentu. Antara corak ini adalah nombor kuantum, empat nombor mudah yang menggambarkan konfigurasi elektronik setiap elemen.
Nombor kuantum timbul secara semulajadi dari model mekanikal mekanikal atom dan dilambangkan oleh huruf: n, ℓ, mℓ dan s. Mereka menggambarkan status tenaga elektron dalam atom setiap elemen kimia.
Melalui jadual berkala tradisional, dan beberapa alat tambahan, adalah mungkin untuk mempunyai konfigurasi elektronik atom dari mana -mana elemen. Kelebihan jadual kuantum adalah bahawa unsur -unsur dianjurkan sedemikian rupa sehingga nombor kuantum mereka dapat dilihat dengan segera, tanpa perlu membuat banyak pengiraan secara berasingan.
Ciri -ciri jadual kuantum
Terdapat beberapa reka bentuk jadual kuantum. Model yang ditunjukkan dalam angka di atas mengandungi:
- Header dengan empat baris, dengan nilai -nilai empat nombor kuantum, n, ℓ, m dan s, ditambah baris kelima dalam kuning, yang sepadan dengan bilangan elektron di orbital terluar.
- Badan meja, yang terdiri daripada grid yang mengandungi simbol elemen kimia, bermula dengan hidrogen, dalam lajur terakhir dari kanan, diikuti oleh helium, dan sebagainya. Nombor di bawah mewakili jumlah elektron atom dalam keadaan asas.
- Di bahagian bawah, di barisan hijau terdapat empat kelas untuk mengatur unsur -unsur: orbital s, p, d dan f (dari kiri ke kanan).
- Akhirnya, di bawah barisan orbital adalah keluarga. Setiap lajur adalah keluarga, berjumlah 1 hingga 32. Sebagai contoh, keluarga 1 dan ke -2 tergolong dalam kelas S, keluarga dari 3 hingga 8a, tergolong dalam kelas P, dan sebagainya.
Apakah jadual kuantum untuk?
Jadual kuantum berfungsi untuk mencari set nombor kuantum yang mencirikan elektron dari atom. Biasanya, elektron ini akan menjadi lapisan paling luar, kerana mereka adalah yang menentukan tingkah laku kimia elemen.
Bagaimana jadual kuantum?
Jadual kuantum membolehkan dengan mudah mencari nombor kuantum elektron di lapisan paling luar atom.
Contoh 1
Untuk menggambarkan prosedur, elemen aluminium diambil sebagai contoh, yang simbolnya adalah. Langkah pertama adalah mencarinya dalam jadual kuantum, menandakannya dengan Bulatan merah:
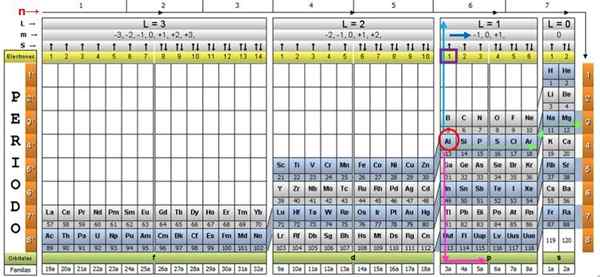
Langkah 1: Cari n
Selepas mencari elemen di dalam meja, anda perlu bergerak melalui baris dan warna yang sama, ke kanan, sehingga anda mencapai lajur oren, mengikuti jalan anak panah hijau yang ditunjukkan dalam imej.
Anak panah menunjuk ke kotak yang ditandakan dengan nombor 3, yang merupakan nombor kuantum utama n:
n = 3
Langkah 2: Cari ℓ
Untuk menentukan nombor kuantum sekunder, anak panah menegak biru diikuti, yang menunjukkan:
ℓ = 1.
Langkah 3: Cari m
Elektron aluminium luaran ditemui dalam keluarga P -penBilling, seperti yang boleh dibaca di barisan hijau, yang mana Pink Arrow Points.
Di samping itu, jumlah elektron di lapisan terakhir dibaca dalam barisan kuning tajuk. Dalam kes aluminium terdapat 1 elektron (diserlahkan di dataran ungu), yang merupakan rujukan. Menggabungkan hasil di atas, konfigurasi lapisan terakhir ialah:
Boleh melayani anda: sel galvanik: bahagian, bagaimana kerja, aplikasi, contoh3p1
Diketahui bahawa lapisan p menyokong maksimum 6 elektron. Dan bilangan m mengambil beberapa nilai keseluruhan - ℓ, ( - ℓ+1), ... 0, ... (+ℓ -1),+ℓ.
Seperti dalam kes ini ℓ = 1, maka M boleh -1, 0, 1.
Nombor -nombor ini muncul dalam barisan tajuk yang sepadan dengan m (lihat dalam gambar Anak panah mendatar biru). Jadual berikut berfungsi sebagai panduan untuk mengetahui apa nilai memilih, bergantung pada kes itu:
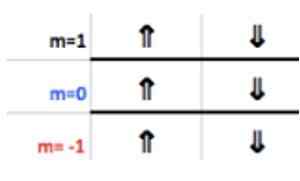
Oleh kerana lapisan aluminium terakhir mempunyai 1 elektron, nombor kuantum magnet sepadan
M = 1.
Langkah 4: Cari s
Nombor putaran S hanya mempunyai dua nilai: +½ atau - ½. Di dalam kotak atas, jika anak panah menunjukkan, ia dipilih s = +½ dan jika ia menunjuk ke bawah, maka s = - ½. Dalam kes aluminium, elektron 1 mata, oleh itu:
S = + ½.
Singkatnya, nombor kuantum elektron lapisan aluminium paling luar kepada bunyi:
n = 3; ℓ = 1; M = 1, s = +½
Contoh 2 (kes yang luar biasa)
Perak AG, dan lebih kurang dua puluh elemen, adalah kes yang luar biasa, jadi penjagaan mesti diambil semasa menggunakan jadual kuantum dengan mereka.
Sekiranya prosedur sebelumnya diulang, Ag akan diperolehi sebagai sub -level terakhir pada 4D9.
Ini kerana konfigurasi yang diramalkan La Plata, oleh pemerintahan Madelung, adalah:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9
Walau bagaimanapun, dalam Amalan AG tidak mengikuti konfigurasi ini dengan tepat, dan juga tidak ada unsur -unsur lain yang lapisan yang diramalkan terakhir adalah 4D9, seperti tembaga dan emas, antara lain (berunding dengan internet untuk mendapatkan senarai lengkap unsur -unsur yang tidak mengikuti peraturan Madelung).
Boleh melayani anda: molealityKonfigurasi sebenar AG ialah:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Di mana elektron lapisan 5S2 melompat ke lapisan 4D9 untuk menyelesaikannya. Dengan cara ini kestabilan atom meningkat. Oleh itu, sub -level terakhir adalah:
5s1
Dan nombor kuantumnya adalah yang sepadan dengan elemen RB, ditunjukkan dalam kotak ungu, dengan anak panah oren menunjuk kepada bilangan yang tinggal:
n = 5; ℓ = 0; m = 0; S = +½
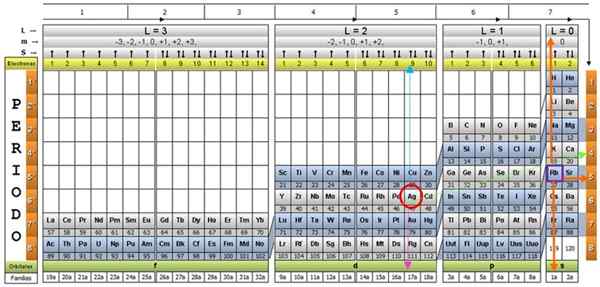 Mengkaji jadual berkala, pada dasarnya dilihat bahawa Ag adalah dalam tempoh 5, ciri yang ditentukan oleh nombor kuantum utama n.
Mengkaji jadual berkala, pada dasarnya dilihat bahawa Ag adalah dalam tempoh 5, ciri yang ditentukan oleh nombor kuantum utama n.
Perbezaan dengan jadual berkala
Kedua -dua jadual adalah dua cara untuk mengatur unsur -unsur kimia mengikut ciri -ciri atom mereka:
-Dalam jadual berkala, unsur -unsur yang terdapat dalam lajur yang sama mempunyai sifat kimia yang serupa. Contohnya, ia bermula dengan lajur Logam Alkali di sebelah kiri dan menamatkan gas mulia di sebelah kanan. Sementara di peringkat adalah unsur -unsur dengan tahap tenaga yang lebih tinggi.
-Jadual Kuantum mempunyai pelupusan melangkah, yang direka mengikut peraturan pengisian. Oleh itu, anda perlu mengikuti langkah -langkah untuk mendapatkan nombor kuantum utama, kecuali dalam hal pengecualian seperti perak, dalam contoh bahagian sebelumnya. Keluarga elemen dalam jadual ini berkaitan melalui orbital atas, dalam s, p, d atau f.
Rujukan
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan McGraw Hill.
- Konfigurasi Elektronik. Konfigurasi elektronik dan nombor kuantum. Diperolehi dari: configuionectronica.com.
- Manual Kimia. Diperolehi dari: DCB.kejuruteraan.Unam.mx.
- Kimia Rasmi. Cara nombor kuantum mudah mudah. Diperolehi daripada: pegawai kimia.com
- Triplenlace. Pengecualian terhadap pemerintahan Madelung dalam konfigurasi elektronik elemen kimia. Diperolehi dari: Triplenlace.com.

