Penyebab ketegangan permukaan, contoh, aplikasi dan eksperimen

- 2452
- 165
- Anthony Breitenberg
The ketegangan permukaan Ini adalah harta fizikal yang semua cecair hadir dan dicirikan oleh rintangan bahawa permukaan mereka menentang peningkatan di kawasan mereka. Ini sama seperti mengatakan bahawa permukaan ini akan mencari kawasan yang paling kurang mungkin. Fenomena ini menghubungkan beberapa konsep kimia, seperti perpaduan, lekatan dan daya intermolecular.
Ketegangan permukaan bertanggungjawab untuk pembentukan kelengkungan permukaan cecair dalam bekas tiub (silinder lulus, lajur, tiub ujian, dll.). Ini boleh menjadi cekung (lembah melengkung) atau cembung (kubah melengkung). Banyak fenomena fizikal dapat dijelaskan memandangkan perubahan yang dialami oleh ketegangan permukaan cecair.
 Bentuk sfera yang diterima pakai oleh titisan air pada daun sebahagiannya disebabkan oleh ketegangan permukaannya. Sumber: Foto yang diambil oleh pengguna Flickr Tanakawho [cc oleh (https: // creativeCommons.Org/lesen/by/2.0)]
Bentuk sfera yang diterima pakai oleh titisan air pada daun sebahagiannya disebabkan oleh ketegangan permukaannya. Sumber: Foto yang diambil oleh pengguna Flickr Tanakawho [cc oleh (https: // creativeCommons.Org/lesen/by/2.0)] Salah satu fenomena ini adalah trend bahawa molekul cecair perlu aglomerat dalam bentuk titisan, ketika mereka terletak di permukaan yang mengusir mereka. Sebagai contoh, air jatuh yang kita lihat di atas daun tidak boleh membasahinya kerana bukitnya, permukaan hidrofobik.
Walau bagaimanapun, terdapat masa apabila graviti memainkan peranannya dan penurunannya tumpah seperti lajur air. Fenomena yang sama berlaku dalam titisan sfera Mercury apabila termometer tumpah.
Sebaliknya, ketegangan air permukaan adalah yang paling penting dari semua, kerana ia menyumbang dan menganjurkan status badan mikroskopik dalam media berair, seperti sel dan membran lipid mereka. Di samping itu, ketegangan ini bertanggungjawab untuk air menguap perlahan -lahan, dan beberapa badan paling padat yang boleh terapung di permukaannya.
[TOC]
Punca ketegangan permukaan
Penjelasan fenomena ketegangan permukaan berada di peringkat molekul. Molekul cecair berinteraksi antara satu sama lain, sehingga mereka bersatu padu dalam pergerakan mereka yang tidak menentu. Molekul berinteraksi dengan jirannya di sebelah dan yang berada di atas atau di bawahnya.
Walau bagaimanapun, ini tidak berlaku sama dengan molekul permukaan cecair, yang bersentuhan dengan udara (atau gas lain), atau dengan pepejal. Molekul permukaan tidak dapat bersatu padu dengan persekitaran luaran.
Akibatnya, mereka tidak mengalami sebarang daya yang menarik mereka; Hanya turun, dari jirannya medium cecair. Untuk mengatasi ketidakseimbangan ini, molekul permukaan "diperah", kerana hanya kemudian mereka berjaya mengatasi daya yang menolaknya.
Boleh melayani anda: Sodium Silicate (Na2Sio3): Struktur, Hartanah, Kegunaan, RisikoPermukaan kemudian dibuat di mana molekul berada dalam pelupusan yang lebih tegang. Sekiranya zarah mahu menembusi cecair, ia mesti terlebih dahulu menyeberangi penghalang molekul ini berkadar dengan ketegangan permukaan cecair tersebut. Perkara yang sama berlaku untuk zarah yang ingin melarikan diri ke persekitaran luaran dari kedalaman cecair.
Oleh itu, permukaannya berkelakuan seolah -olah ia adalah filem elastik yang menunjukkan ketahanan terhadap ubah bentuk.
Unit
Ketegangan permukaan biasanya diwakili dengan simbol γ, dan dinyatakan dalam unit N/M, kekuatan dengan panjang. Walau bagaimanapun, kebanyakan masa unit anda adalah Dyn/cm. Seseorang boleh menjadi yang lain melalui faktor penukaran seterusnya:
1 Dyn/cm = 0.001 N/m
Ketegangan air permukaan
Air adalah barat dan paling mengejutkan semua cecair. Ketegangan permukaannya, serta beberapa sifatnya, mempunyai nilai yang luar biasa tinggi: 72 dyn/cm pada suhu bilik. Nilai ini boleh meningkat kepada 75.64 dyn/cm, pada suhu 0 ºC; atau menurun hingga 58.85 ºC, pada suhu 100 ºC.
Pemerhatian ini masuk akal jika dianggap bahawa penghalang molekul lebih tegang lebih pada suhu yang dekat dengan titik pembekuan, atau "melonggarkan" lebih sedikit di sekitar titik mendidih.
Air mempunyai ketegangan permukaan yang hebat berikutan jambatan hidrogennya. Sekiranya ini terkenal di dalam cecair, mereka lebih banyak di permukaan. Molekul air sangat saling berkaitan dengan membentuk interaksi dipole-dipolo jenis h2Oh oh.
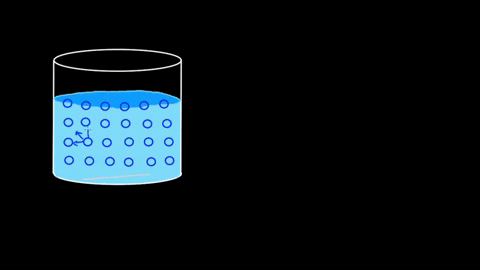 Molekul air menarik satu sama lain; Mereka dikaitkan dengan jambatan hidrogen
Molekul air menarik satu sama lain; Mereka dikaitkan dengan jambatan hidrogen Kecekapan interaksinya sedemikian rupa sehingga penghalang molekul berair bahkan dapat mengekalkan beberapa badan sebelum mereka tenggelam. Di bahagian aplikasi dan eksperimen, titik ini akan disambung semula.
Contoh lain
Semua cecair mempunyai ketegangan permukaan, sama ada ke tahap yang lebih rendah atau lebih tinggi daripada air, atau jika ia adalah bahan atau penyelesaian murni. Betapa kuat dan tegang adalah halangan molekul mereka yang cetek, ia akan bergantung secara langsung pada interaksi intermolecularnya, sebagai tambahan kepada faktor struktur dan tenaga.
Gas pekat
Sebagai contoh, molekul gas dalam keadaan cair hanya berinteraksi antara satu sama lain melalui kuasa dispersif di London. Ini bersetuju dengan hakikat bahawa ketegangan dangkal mereka mempunyai nilai yang rendah:
-Helium cecair, 0.37 Dyn/cm A -273 ºC
Ia boleh melayani anda: Ammonium Chloride (NH4CL)-Nitrogen cecair, 8.85 Dyn/cm A -196 ºC
-Oksigen cecair, 13.2 Dyn/cm A -182 ºC
Ketegangan permukaan oksigen cecair lebih besar daripada helium kerana molekulnya mempunyai jisim yang lebih besar.
Cecair apolar
Dari cecair apolar dan organik, mereka dijangka mempunyai ketegangan permukaan yang lebih tinggi daripada gas pekat ini. Di antara sebahagian daripada mereka kita mempunyai perkara berikut:
-Dietileter, 17 dyn/cm pada 20 ºC
-n-Hexano, 18.40 dyn/cm pada 20 ºC
-n-Octane, 21.80 dyn/cm pada 20 ºC
-Toluena, 27.73 dyn/cm pada 25 ºC
Trend yang sama diperhatikan untuk cecair ini: ketegangan permukaan meningkat apabila massa molekulnya meningkat. Walau bagaimanapun n-Octane sepatutnya, mengikut ini, mempunyai ketegangan permukaan yang paling besar dan bukan toluena. Di sini struktur molekul dan geometri dimainkan.
Molekul toluena, pelan dan anillares mempunyai interaksi yang lebih berkesan daripada yang n-Octane. Oleh itu, permukaan toluena adalah "tegang" daripada permukaan n-Octane.
Cecair kutub
Menjadi lebih kuat dipole-dipol. Tetapi tidak selalu berlaku. Antara beberapa contoh yang kita ada:
-Asid asetik, 27.60 dyn/cm pada 20 ºC
-Aseton, 23.70 dyn/cm pada 20 ºC
-Darah, 55.89 dyn/cm pada suhu 22 ° C
-Etanol, 22.27 dyn/cm pada 20 ºC
-Gliserol, 63 dyn/cm pada 20 ºC
-Natrium klorida cair, 163 dyn/cm pada 650 ºC
-Penyelesaian NaCl 6 m, 82.55 dyn/cm pada 20 ºC
Natrium klorida cair dijangka mempunyai ketegangan permukaan yang besar: ia adalah cecair likat dan ionik.
Sebaliknya, merkuri adalah salah satu cecair dengan ketegangan permukaan tertinggi: 487 Dyn/cm. Di dalamnya, permukaannya terdiri daripada atom merkuri yang kuat, lebih banyak daripada molekul air.
Aplikasi
 Beberapa serangga menggunakan ketegangan permukaan air untuk berjalan di atasnya. Sumber: Pixabay.
Beberapa serangga menggunakan ketegangan permukaan air untuk berjalan di atasnya. Sumber: Pixabay. Ketegangan cetek sahaja tidak mempunyai aplikasi. Walau bagaimanapun, ini tidak bermakna bahawa ia tidak terlibat dalam beberapa fenomena harian, bahawa jika tidak, mereka tidak akan berlaku.
Sebagai contoh, nyamuk dan serangga lain dapat berjalan melalui air. Ini kerana kaki hidrofobik mereka menghalau air, pada masa yang sama bahawa jisim kecil mereka membolehkan mereka.

Ketegangan cetek juga memenuhi peranan dalam pembasahan bendalir. Semakin besar ketegangannya yang cetek, semakin kecil kecenderungannya bocor melalui liang atau anak ayam bahan. Di samping itu, mereka adalah sedikit cecair berguna untuk membersihkan permukaan.
Boleh melayani anda: reaksi peneutralanDetergen
Di sinilah detergen bertindak, mengurangkan ketegangan permukaan air, dan membantunya untuk menutup permukaan yang lebih besar; Semasa meningkatkan tindakan degreaser anda. Dengan mengurangkan ketegangannya yang cetek, ia menampung molekul udara, dengan bentuk gelembung.
Emulsi
Sebaliknya, ketegangan yang lebih rendah lebih tinggi dikaitkan dengan penstabilan emulsi, sangat penting dalam perumusan pelbagai produk yang berlainan.
Eksperimen mudah
 Klip logam terapung kerana ketegangan air permukaan. Sumber: Alvesgaspar [CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Klip logam terapung kerana ketegangan air permukaan. Sumber: Alvesgaspar [CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)] Akhirnya, beberapa eksperimen yang boleh dilakukan di mana -mana ruang domestik akan disebutkan.
Eksperimen klip
Dalam gelas dengan air sejuk, klip logam diletakkan di permukaannya. Seperti yang dilihat pada imej atas, klip itu akan terus berterima kasih kepada ketegangan permukaan air. Tetapi jika sedikit lava loza ditambah ke kaca, ketegangan permukaan akan berkurang secara dramatik dan klip akan tiba -tiba tenggelam.

Kapal kertas
Sekiranya kita mempunyai kapal kertas atau palet kayu, dan jika anda mencuci sedikit atau detergen, ia ditambah di kepala swab, maka fenomena yang menarik akan berlaku: akan ada penolakan yang akan menyebarkannya ke arah tepi dari kaca. Kapal Kertas dan Palet Kayu akan bergerak dari swab.

Percubaan lain yang serupa dan lebih grafik adalah mengulangi operasi yang sama, tetapi dalam baldi air disembur dengan lada hitam. Zarah lada hitam akan bergerak dan permukaan akan pergi dari lada menjadi kristal, dengan tepi di tepi.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Ketegangan permukaan. Diperoleh dari: dalam.Wikipedia.org
- USGS. (s.F.). Ketegangan permukaan dan air. Diperolehi dari: USGS.Gov
- Jones, Andrew Zimmerman. (12 Februari 2020). Ketegangan permukaan - Definisi dan eksperimen. Pulih dari: Thoughtco.com
- Susanna Lauren. (15 November 2017). Mengapa ketegangan permukaan penting? Biolin Scientific. Pulih dari: blog.Biolinscientific.com
- Sains keibubapaan Rookie. (7 November 2019). Apakah ketegangan permukaan | Eksperimen sains yang sejuk. Pulih dari: rookieparenting.com
- Jessica Mock. (2020). Eksperimen ketegangan permukaan. Kajian. Pulih dari: belajar.com
- Kanak -kanak itu mesti melihat ini. (2020). Tujuh Eksperimen Ketegangan Surface - Gadis Fizik. Pulih dari: thekidshouldseethis.com

