Sejarah teori kinetik molekul, postulates dan contoh

- 2957
- 709
- Mr. Tracy Parisian
The Teori kinetik molekul Ia adalah salah satu yang bertujuan untuk menjelaskan pemerhatian eksperimen gas dari perspektif mikroskopik. Iaitu, ia cuba mengaitkan sifat dan tingkah laku zarah gas, dengan ciri -ciri fizikal gas sebagai cecair; Terangkan makroskopik dari mikroskopik.
Gas selalu menjadi objek minat saintis kerana sifatnya. Mereka menduduki keseluruhan jumlah bekas di mana mereka dapat memampatkan sepenuhnya tanpa kandungan mereka menentang rintangan yang lebih rendah; Dan jika suhu meningkat, bekas mula berkembang, dan bahkan boleh retak.
 Zarah gas dalam keadaan jauh atau dekat dengan pencairan. Sumber: Olivier Cleynen dan Pengguna: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Zarah gas dalam keadaan jauh atau dekat dengan pencairan. Sumber: Olivier Cleynen dan Pengguna: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Banyak sifat dan tingkah laku ini diringkaskan dalam undang -undang gas ideal. Walau bagaimanapun, mereka menganggap gas secara keseluruhan dan bukan sebagai satu set berjuta -juta zarah tersebar di ruang angkasa; Di samping itu, ia tidak memberikan, dari tekanan, jumlah dan data suhu, lebih banyak maklumat mengenai bagaimana zarah -zarah ini bergerak.
Oleh itu, teori kinetik molekul (TCM), bercadang untuk memvisualisasikannya sebagai sfera mudah alih (imej unggul). Sfera ini bertembung antara satu sama lain dan dinding sewenang -wenangnya, dan mengekalkan trajektori linear. Walau bagaimanapun, apabila suhu berkurangan dan tekanan meningkat, trajektori sfera menjadi lengkung.
Gas, menurut TCM, mesti berkelakuan seperti sfera kotak imej pertama. Tetapi, apabila disejukkan dan meningkatkan tekanan pada mereka, tingkah laku mereka bergerak dari ideal. Mereka kemudian gas sebenar, dekat dengan pencairan dan pergi ke fasa cecair.
Di bawah syarat -syarat ini, interaksi antara sfera menjadi lebih penting, sehingga kelajuan mereka seketika perlahan. Semakin dekat mereka dari pencairan, lebih banyak melengkung trajektori mereka (kotak kanan) menjadi, dan perlanggaran mereka kurang tenaga.
[TOC]
Sejarah
Daniel Bernoulli
Idea sfera ini, lebih baik dipanggil atom, telah dipertimbangkan oleh ahli falsafah Rom Lucretius; Bukan untuk gas, tetapi untuk objek pepejal, statik. Sebaliknya, pada tahun 1738 Daniel Bernoulli menggunakan visi atom ke gas dan cecair dengan membayangkan mereka sebagai sfera tidak senonoh yang bergerak ke semua arah.
Walau bagaimanapun, kerjanya melanggar undang -undang fizik pada masa itu; Tubuh tidak dapat bergerak selama -lamanya, jadi mustahil untuk berfikir bahawa satu set atom dan molekul bertembung antara satu sama lain tanpa kehilangan tenaga mereka; iaitu kewujudan perlanggaran elastik tidak mungkin.
Rudolf Clausius
Satu abad kemudian, penulis lain memperkuat TCM dengan model di mana zarah gas bergerak ke satu arah. Rudolf Clausius, bagaimanapun, menyusun hasilnya dan bersenjata model TCM yang lebih lengkap yang mana ia berusaha untuk menjelaskan undang -undang gas yang ideal yang ditunjukkan oleh Boyle, Charles, Dalton dan Avogadro.
Boleh melayani anda: coulombimetry: asas, jenis, aplikasiJames Clerk Maxwell dan Ludwig Boltzmann
Pada tahun 1859, kerani James Maxwell menyatakan bahawa zarah -zarah gas mempamerkan pelbagai kelajuan pada suhu tertentu, dan satu set mereka dapat dipertimbangkan dengan kelajuan molekul rata -rata.
Kemudian, pada tahun 1871 Ludwig Boltzmann menghubungkan idea -idea yang ada dengan entropi, dan bagaimana termodinamik selalu cenderung untuk menduduki ruang maksimum yang mungkin dalam cara yang homogen dan spontan.
Teori kinetik molekul postulate
Untuk mempertimbangkan gas dari zarahnya, model di mana postulat atau andaian tertentu dipenuhi; Dirumuskan secara logiknya harus dapat meramalkan dan menerangkan (sebagai setia mungkin) pemerhatian makroskopik dan eksperimen. Yang mengatakan, postulates TCM disebutkan dan digambarkan.
Jumlah zarah gas boleh diabaikan
Dalam bekas yang penuh dengan zarah gas, mereka menyebarkan dan bergerak di antara mereka melalui semua sudut. Sekiranya seketika mereka semua dapat bertemu di titik tertentu bekas, tanpa pencairan, ia akan diperhatikan bahawa mereka hampir tidak menduduki sebahagian daripada jumlah bekas.
Ini bermakna bahawa dalam bekas, walaupun ia mengandungi berjuta-juta zarah gas, ia benar-benar lebih kosong daripada penuh (nisbah volum-vacío kurang daripada 1); Oleh itu, jika halangannya membenarkannya, dia dan gas di dalamnya boleh dimampatkan secara tiba -tiba; Sejak dipertimbangkan zarahnya sangat kecil, seperti jumlahnya.
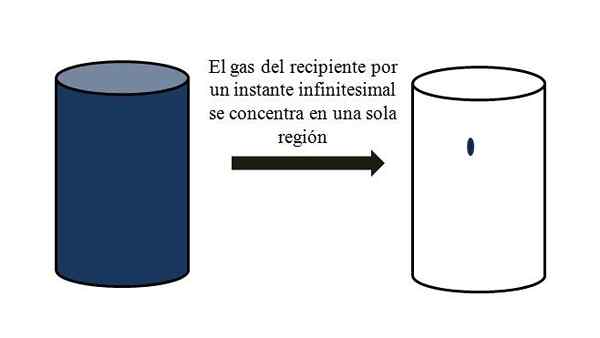 Hubungan volum-vacío gas dalam bekas. Sumber: Gabriel Bolívar.
Hubungan volum-vacío gas dalam bekas. Sumber: Gabriel Bolívar. Imej unggul tepat menggambarkan apa yang dikomentari di atas, menggunakan gas kebiruan.
Daya tarikan antara zarah adalah batal
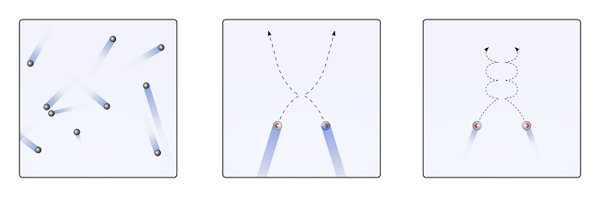
Zarah -zarah gas di dalam bekas bertembung antara satu sama lain tanpa masa yang mencukupi untuk interaksi mereka menjadi kekuatan; Lebih kurang apabila apa yang mengelilingi mereka adalah molekul kosong. Akibat segera ini ialah trajektori linear mereka membolehkan mereka sepenuhnya menutupi jumlah bekas.
Sekiranya di atas tidak begitu, bekas "pelik" dan "labyrinthic" akan mempunyai kawasan basah akibat pemeluwapan gas; Sebaliknya, zarah -zarah mengembara ke seluruh bekas dengan kebebasan penuh, tanpa kekuatan interaksi mereka menghentikannya.
Boleh melayani anda: asid klorik (HCLO3) Membuang zarah gas apabila interaksi adalah batal atau tidak penting (ke., linear), dan apabila mereka penting (b., lengkung). Sumber: Gabriel Bolívar.
Membuang zarah gas apabila interaksi adalah batal atau tidak penting (ke., linear), dan apabila mereka penting (b., lengkung). Sumber: Gabriel Bolívar. Trajektori linear imej atas (a.) menunjukkan postulat ini; Walaupun jika trajektori adalah lengkung (b.), bukti bahawa terdapat interaksi yang tidak dapat diabaikan di antara zarah.
Zarah gas sentiasa bergerak
Dari dua postulates pertama berkumpul selain hakikat bahawa zarah gas tidak pernah berhenti bergerak. Setelah kabur di dalam bekas, mereka bertembung antara satu sama lain dan dengan dinding yang sama, dengan daya dan kelajuan berkadar terus dengan suhu mutlak; Daya ini, tekanan.
Sekiranya zarah gas berhenti bergerak seketika, ia akan disaksikan di dalam "bahasa asap", yang timbul dari apa -apa, dengan masa yang cukup untuk memerintahkan diri mereka dalam vakum dan memberi cara rawak.
Perlanggaran antara zarah dan dinding bekas adalah elastik
Jika perlanggaran elastik antara zarah gas dan dinding bekas tidak akan berlaku di dalam bekas, ia tidak akan berlaku (sementara keadaan fizikal tidak berubah) pemeluwapan gas; atau apa yang sama seperti mengatakan bahawa mereka tidak pernah berehat dan mereka sentiasa bertembung.
Ini kerana dalam perlanggaran elastik tidak ada kehilangan tenaga kinetik; Zarah bertembung dengan dinding dan melantun pada kelajuan yang sama. Sekiranya zarah apabila perlanggaran menurunkan kelajuan, yang lain mempercepatkan, tanpa haba atau bunyi yang menghilangkan tenaga kinetik dari mana -mana.
Tenaga kinetik tidak tetap berterusan
Pergerakan zarah adalah rawak dan huru -hara, sehingga tidak semua membawa kelajuan yang sama; Seperti yang berlaku, sebagai contoh, di lebuh raya atau di kalangan orang ramai. Ada yang lebih bertenaga dan bergerak lebih cepat, sementara yang lain lambat, menunggu perlanggaran untuk mempercepatnya.
Untuk menerangkan kelajuan anda, maka perlu untuk mengira purata; Dan dengan ini, purata tenaga kinetik zarah atau molekul gas diperolehi. Oleh kerana tenaga kinetik semua zarah sentiasa berubah, purata membolehkan kawalan data yang lebih baik dan anda boleh bekerja dengan kebolehpercayaan yang lebih besar.
Tenaga kinetik purata sama dengan suhu tertentu untuk semua gas
Tenaga kinetik molekul purata (ECMP) Dalam bekas ia diubahsuai dengan suhu. Pada suhu yang lebih tinggi, tenaga ini akan lebih besar. Kerana ia adalah purata, mungkin terdapat zarah atau soda yang mempunyai tenaga yang lebih besar atau lebih rendah berkenaan dengan nilai ini; masing -masing lebih cepat dan lebih lambat, masing -masing.
Boleh melayani anda: Asid dan Pangkalan: Perbezaan, Ciri, ContohSecara matematik dapat ditunjukkan bahawa ECMP Ia bergantung secara eksklusif pada suhu. Ini bermakna tidak kira apa gas, jisim molekul atau strukturnya, ECnyaMP Ia akan sama pada suhu t dan hanya akan berubah jika ia meningkat atau berkurangan. Dari semua postulates mungkin ini adalah yang paling relevan.
Dan bagaimana dengan kelajuan molekul purata? Tidak seperti ECMP, Jisim molekul mempengaruhi kelajuan. Semakin berat molekul zarah atau gas, adalah wajar untuk mengharapkan untuk bergerak lebih perlahan.
Contoh
Berikut adalah beberapa contoh ringkas bagaimana TCM telah berjaya memberi penjelasan kepada undang -undang gas ideal. Walaupun mereka tidak ditangani, fenomena lain, seperti penyebaran dan pengalihan gas, juga boleh dijelaskan dengan TCM.
Undang -undang Boyle
Jika jumlah bekas dimampatkan pada suhu malar, jarak zarah gas mesti bertabrakan untuk bertabrakan terhadap dinding berkurangan; yang sama dengan peningkatan kekerapan perlanggaran ini, mengakibatkan tekanan yang lebih besar. Apabila suhu tetap, ECMP Ia juga tetap.
Charles Law
Sekiranya T, EC meningkatMP akan meningkat. Zarah gas akan bergerak lebih cepat dan bertembung lebih banyak kali dengan dinding bekas; Meningkatkan tekanan.
Jika dinding fleksibel, mampu berkembang, kawasannya akan menjadi lebih besar dan tekanan akan jatuh sehingga ia menjadi malar; Dan sebagai hasilnya, jumlahnya juga akan meningkat.
Undang -undang Dalton
Sekiranya beberapa liter gas yang berbeza ditambah dalam bekas yang luas, dari bekas yang lebih kecil, tekanan dalamannya akan sama dengan jumlah tekanan separa yang dikenakan oleh setiap jenis gas secara berasingan.
Kerana? Kerana semua gas mula bertabrakan antara satu sama lain dan menyebarkan homogen; Interaksi di antara mereka adalah tidak sah, dan vakum mendominasi dalam bekas (postulates TCM), jadi seolah -olah setiap gas ditemui bersendirian, menimbulkan tekanannya secara individu tanpa gangguan gas lain.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage, p 426-431.
- Fernández Pablo. (2019). Teori kinetik molekul. VIX. Pulih dari: vix.com
- Jones, Andrew Zimmerman. (7 Februari 2019). Teori molekul kinetik gas. Pulih dari: Thoughtco.com
- Dewan Nancy. (5 Mei 2015). Teori Kinetik Gas. Pusat Penyelidikan Glenn. Diperolehi dari: GRC.periuk.Gov
- Blaber m. & Lebih rendah s. (9 Oktober 2018). Asas teori molekul kinetik. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Teori molekul kinetik. Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Teori Kinetik Gas. Diperoleh dari: dalam.Wikipedia.org
- Toppr. (s.F.). Teori molekul kinetik gas. Pulih dari: TOPPR.com

