Sistem teori perlanggaran, tenaga, contoh
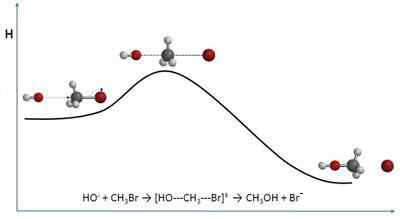
- 3805
- 624
- Delbert Dare
The Teori perlanggaran Terangkan kelajuan tindak balas kimia dari perspektif molekul yang semata -mata. Oleh itu, ia hampir rapat dengan kinetik kimia. Daripada menghampiri kelajuan dari segi kepekatan, ia berbuat demikian berdasarkan frekuensi perlanggaran.
Semasa bercakap mengenai perlanggaran, imej bola biliard dapat mengingatkan antara satu sama lain di atas meja. Walau bagaimanapun, molekul, walaupun teori ini mengandaikan bahawa bentuknya adalah sfera, tidak berkelakuan sama. Perlanggaran molekul berbeza dalam beberapa cara, baik ruang dan tenaga.

Teori ini, walaupun ia boleh secara matematik agak kompleks dan menunjukkan variasi yang besar mengenai hasil eksperimen, menawarkan imej tafsiran yang kelihatan dan tanpa aspek abstrak.
Walaupun ia digunakan untuk sistem gas atau penyelesaian yang sangat dicairkan, prinsipnya dapat diperluaskan kepada sebarang reaksi dan medium fizikal.
[TOC]
Syarat untuk reaksi berlaku
Menurut Teori Perlanggaran terdapat tiga syarat untuk reaksi berlaku:
- Spesies kimia (ion, molekul, radikal, dll.) Mereka mesti bertembung dengan cekap.
- Mereka mesti membawa tenaga yang mencukupi untuk pecahan pautan mereka.
- Di samping itu, orientasi kesan mesti sangat spesifik.
Perlanggaran molekul
 Seperti dalam bowling, tindak balas hanya berlaku apabila perlanggaran yang cekap berlaku dari segi tenaga dan bimbingan
Seperti dalam bowling, tindak balas hanya berlaku apabila perlanggaran yang cekap berlaku dari segi tenaga dan bimbingan Perlanggaran molekul berkongsi sesuatu yang sama dengan makroskopik: ia berlaku terutamanya antara dua spesies atau badan. Dua bola biliard bertembung antara satu sama lain, serta bola bola sepak melawan dinding, atau dua projektil di tengah -tengah udara. Iaitu perlanggaran berkaitan dengan kimia dan tindak balasnya cenderung menjadi jenis bimolecular.
Boleh melayani anda: Pengionan dalam Fizik dan Kimia: Konsep, Proses dan ContohnyaMolekul tidak masih ada, tetapi mereka bergerak dan berputar melalui ruang yang mengelilinginya. Dengan berbuat demikian, diandaikan bahawa mereka melukis sejenis bulatan yang dipanggil seksyen silang, di mana terdapat kebarangkalian molekul colison lain. Begitu juga, teori menganggap bahawa molekul adalah sfera untuk memudahkan model matematik.
Dua molekul, sfera hipotesis, boleh bertembung tanpa sebarang masalah, walaupun tidak ada reaksi kimia. Tetapi ia tidak berlaku dengan cara yang sama ketika datang ke tiga, empat atau lebih molekul.
Lebih banyak spesies mereka harus bertembung untuk berasal dari produk, semakin tidak mungkin fenomena menjadi. Ini secara visual dijelaskan mencuba tiga bola atau projektil berlanggar pada masa yang sama bersama. Oleh itu, perlanggaran bimolecular adalah yang paling biasa.
Sistem
Teori perlanggaran hanya sah untuk sistem perisian atau fasa. Ini kerana gas menunjukkan tingkah laku yang dapat digambarkan dengan baik oleh kinetik mereka.
Untuk fasa cecair atau penyelesaian yang sangat dicairkan, spesies reaktif dibalut dengan sangkar molekul pelarut, yang mana mereka juga bertembung. Ini mengubah panorama, kerana reaksi tidak hanya bergantung pada frekuensi perlanggaran, tetapi juga pada penyebaran molekul reaktan melalui medium.
Tenaga perlanggaran
Molekul dapat bertembung perlahan -lahan atau sangat cepat. Ini bergantung pada seberapa besar tenaganya, yang pada gilirannya berbeza dengan suhu. Semakin kuat perlanggaran, kebarangkalian bahawa terdapat tindak balas kimia akan meningkat, kerana tenaga ini dapat memecahkan pautan yang diperlukan untuk membentuk yang baru.
Boleh melayani anda: monomerTenaga ini dikenali sebagai pengaktifan, danKe, Dan ia adalah ciri untuk sebarang reaksi kimia. Apabila suhu meningkat, purata molekul mampu memadankan atau melebihi eKe, Oleh itu, bilangan perlanggaran yang berkesan dan, oleh itu, produk terbentuk, meningkat.
Di hadapan pemangkin danKe berkurangan, kerana ia menyediakan permukaan dan elektronik cara yang memberi manfaat kepada perlanggaran. Hasilnya: kadar tindak balas meningkat, tanpa meningkatkan suhu atau menambah reagen lain.
Faktor sterik
Spesies kimia bertembung dengan berkesan untuk bertindak balas, meramalkan teori ini apa yang akan menjadi kelajuan reaksi mereka. Walau bagaimanapun, eksperimen telah menunjukkan bahawa struktur reagen yang lebih kompleks adalah, semakin besar penyimpangan atau perbezaan antara kelajuan teori dan eksperimen.
Ini kerana molekul jauh dari sfera, tetapi secara spasial mempunyai semua jenis geometri. Di sinilah faktor sterik memasuki, ρ, dengan mana ia bertujuan untuk membetulkan kelajuan tindak balas supaya ramalan teori dengan hasil eksperimen lebih baik.
Contoh reaksi
Tindak balas bimolecular
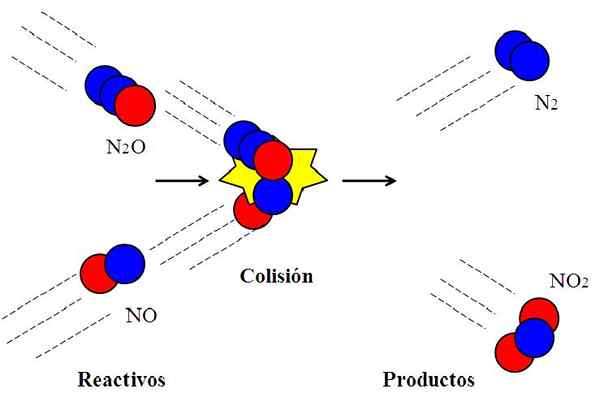 Perlanggaran berkesan antara oksida nitrogen. Sumber: Gabriel Bolívar.
Perlanggaran berkesan antara oksida nitrogen. Sumber: Gabriel Bolívar. Reaksi berikut:
N2O + tidak → n2 + Tidak2
Ia biasanya digunakan untuk menjelaskan maksud orientasi yang berkesan dalam perlanggaran molekul.
Molekul n2Atau, dyitrogen oksida, ia tidak akan bertindak balas dengan NO, nitrik oksida, kecuali semasa perlanggaran atom oksigen (bulatan merah) dari n2Atau kejutan secara langsung dengan atom nitrogen (bulatan biru) dari no. Hanya dengan cara ini produk n akan berasal2 dan tidak2; Jika tidak, molekul n2O dan mereka tidak akan melantun tanpa bertindak balas.
Boleh melayani anda: keadaan gas: ciri -ciri, undang -undang umum, contohIni adalah contoh perlanggaran bimolecular untuk reaksi bimolecular asas. Walaupun reagen mempunyai tenaga yang cukup untuk memecahkan pautan, jika orientasi tidak sesuai, tidak akan ada reaksi kimia.
Reaksi unimolecular
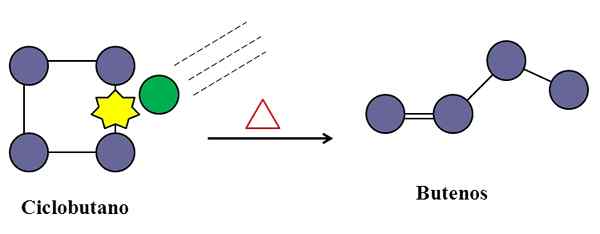 Perlanggaran juga sangat diperlukan untuk isomerisasi cyclobutane. Sumber: Gabriel Bolívar.
Perlanggaran juga sangat diperlukan untuk isomerisasi cyclobutane. Sumber: Gabriel Bolívar. Dalam tindak balas asas yang tidak biasa, perlanggaran molekul juga boleh campur tangan, walaupun hanya spesies yang mengalami transformasi atau pecahan pautannya.
Pertimbangkan sebagai contoh isomerisasi siklobutane untuk menimbulkan campuran butanes. Apabila suhu meningkat, molekul siklobutane akan bergetar pada frekuensi yang lebih tinggi dan bertembung dengan daya yang lebih besar. Produk, bagaimanapun, menunjukkan bahawa dua molekul siklobutane tidak bertindak balas terhadap satu sama lain kerana jika tidak, mereka akan menghasilkan sebatian dengan lapan karbon.
Di tengah-tengah mungkin terdapat kekotoran (lingkaran hijau), yang juga bertembung dengan siklobutane, khususnya pada mana-mana pautan C-C. Ini boleh menjadi gas mulia, atau tidak sangat molekul reaktif seperti nitrogen.
Akan tiba masanya kekotoran akan bertembung dengan tenaga yang mencukupi untuk memecahkan salah satu pautan C-C dari siklobutane. Dan kemudian, molekulnya akan berusaha untuk menyusun semula dan berasal dari buutene, dapat dikenali untuk ikatan ganda dan struktur rantai linearnya.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Glasstone. (1970). Perjanjian Fizikokimia. Aguilar s. Ke. edisi, Juan Bravo, 38, Madrid (Sepanyol).
- Walter J. Moore. (1962). Kimia Fizikal. (Edisi Keempat). Longmans.
- Wikipedia. (2020). Teori perlanggaran. Diperoleh dari: dalam.Wikipedia.org
- Editor enyclopaedia Britannica. (2020). Teori perlanggaran. Britannica Encyclopaedia. Pulih dari: Britannica.com
- Clark Jim. (2018). Teori Colision Kadar Reaksi. Pulih dari: chemguide.co.UK
- Lawson ms. & Lebih rendah s. (18 Mei 2020). Teori Colision. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- « Ciri teks didaktik, struktur, jenis dan contoh
- Negara dan ciri -ciri Amerika atau Antilles yang insular »

