Teori Laut Asas dan Properties Elektron
- 3292
- 85
- Delbert Dare
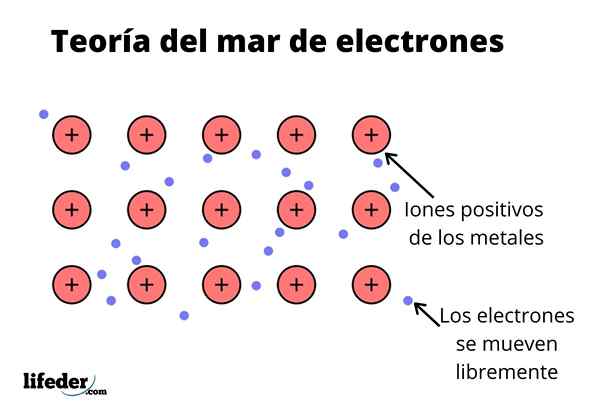
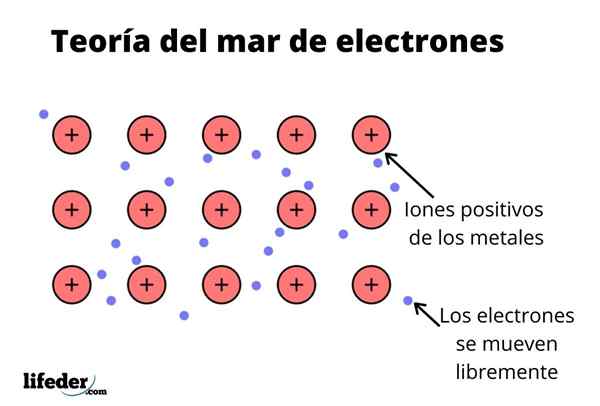
The Teori Laut Elektron Ia adalah hipotesis yang menerangkan fenomena kimia yang luar biasa yang berlaku dalam ikatan logam antara unsur -unsur dengan elektronegativiti yang rendah. Ini adalah perkongsian elektron antara atom bersatu yang berbeza melalui ikatan logam.
Ketumpatan elektronik antara bon ini sedemikian rupa sehingga elektron dipindahkan dan membentuk "laut" di mana mereka bergerak dengan bebas. Ia juga boleh dinyatakan oleh mekanik kuantum: beberapa elektron (biasanya ada satu hingga tujuh setiap atom) diatur di orbital dengan pelbagai pusat yang diregangkan oleh permukaan logam.
Juga, elektron mengekalkan beberapa lokasi dalam logam, walaupun taburan kebarangkalian awan elektronik mempunyai ketumpatan yang lebih besar di sekitar beberapa atom tertentu. Ini kerana apabila arus tertentu digunakan, mereka menunjukkan kekonduksian mereka dalam arah tertentu.
[TOC]
Asas Teori Laut Elektron
Unsur -unsur logam mempunyai kecenderungan yang besar untuk mendermakan elektron tahap tenaga terbaru mereka (lapisan valensi), kerana tenaga pengionan rendah mereka berhubung dengan unsur -unsur lain.
Mengetahui ini, setiap elemen logam boleh dianggap sebagai kation yang dikaitkan dengan elektron tahap tenaga terakhirnya, yang akan lebih mudah didermakan.
Seperti dalam logam terdapat sebilangan besar atom yang dikaitkan antara satu sama lain, dapat diandaikan bahawa logam ini membentuk sekumpulan kation logam yang terjun ke dalam sejenis lautan elektron valensi yang mempunyai penempatan semula yang besar.
Memandangkan daya tarikan elektrostatik di antara kation (beban positif) dan elektron (beban negatif) mempunyai atom logam yang dikaitkan dengan kuat, bayangkan penempatan semula elektron valensi berkelakuan sebagai pelekat elektrostatik yang mengekalkan kation logam.
Boleh melayani anda: polimerDengan cara ini, dapat disimpulkan bahawa semakin besar bilangan elektron yang ada di lapisan logam Valencia, pelekat elektrostatik seperti ini akan mempunyai kekuatan yang lebih besar.
Sifat
Teori Laut Elektron menawarkan penjelasan ringkas kepada ciri -ciri spesies logam seperti rintangan, kekonduksian, kemuluran dan kebolehtelapan, yang berbeza dari satu logam ke yang lain.
Telah ditemui bahawa rintangan yang diberikan kepada logam adalah disebabkan oleh penempatan semula elektron mereka, yang menghasilkan daya perpaduan yang sangat tinggi antara atom yang membentuknya.
Dengan cara ini, kemuluran dikenali sebagai keupayaan bahan -bahan tertentu untuk membolehkan ubah bentuk struktur mereka, tanpa memberi cukup untuk memecahkan, ketika mereka tertakluk kepada kekuatan tertentu.
Penghapusan dalam bentuk lapisan
Kedua -dua kemuluran dan kelembapan logam ditentukan oleh fakta bahawa elektron Valencia diturunkan ke semua arah dalam bentuk lapisan, yang menjadikan mereka menggantikan satu sama lain sebelum tindakan daya luaran, mengelakkan pecahan struktur logam tetapi membenarkan ubah bentuknya.
Begitu juga, kebebasan pergerakan elektron berpindah membolehkan aliran arus elektrik menjadi, menyebabkan logam mempunyai kekonduksian elektrik yang sangat baik.
Di samping itu, fenomena pergerakan elektron bebas ini membolehkan pemindahan tenaga kinetik antara kawasan logam yang berbeza, yang menggalakkan penghantaran haba dan menjadikan logam menunjukkan kekonduksian terma yang hebat.
Ia boleh melayani anda: asid iodose (HiO2): sifat dan kegunaanTeori Laut Elektron dalam Kristal Logam
Kristal adalah bahan pepejal yang mempunyai sifat fizikal dan kimia - sebagai ketumpatan, pencairan dan titik kekerasan - yang ditubuhkan oleh jenis daya yang menjadikan zarah -zarah yang terdiri daripada mereka disimpan bersama.
Dengan cara ini, dianggap bahawa kristal logam mempunyai struktur yang paling mudah, kerana setiap "titik" rangkaian kaca telah diduduki oleh atom logam itu sendiri.
Dalam erti kata yang sama, telah ditentukan bahawa struktur kristal logam umumnya padu dan memberi tumpuan kepada wajah atau badan.
Walau bagaimanapun, spesies ini juga boleh mempunyai bentuk heksagon dan mempunyai pembungkusan yang cukup padat, yang memberi mereka ketumpatan besar yang merupakan ciri mereka.
Disebabkan sebab struktur ini, pautan yang terbentuk dalam kristal logam berbeza daripada yang berlaku di kelas kristal lain. Sepanjang struktur kristal, elektron yang boleh membentuk ikatan, seperti yang dijelaskan di atas, sebelum ini dijelaskan.

Kekurangan teori
Dalam atom logam terdapat sedikit elektron valensi berkadar dengan tahap tenaga mereka; Iaitu, terdapat lebih banyak keadaan tenaga yang tersedia daripada jumlah elektron yang dipautkan.
Ini menunjukkan bahawa, kerana terdapat penempatan semula elektronik yang kuat dan juga band tenaga yang telah diisi sebahagiannya, elektron boleh bergerak melalui struktur reticular apabila mereka tertakluk kepada medan elektrik dari luar negara, selain membentuk lautan elektron yang mengakui kebolehtelapan dari kebolehtelapan rangkaian.
Boleh melayani anda: OxácidoOleh itu, kesatuan logam ditafsirkan sebagai konglomerat ion positif ditambah dengan laut elektron (beban negatif).
Walau bagaimanapun, terdapat ciri -ciri yang tidak dijelaskan melalui model ini, seperti pembentukan aloi tertentu antara logam dengan komposisi tertentu atau kestabilan pautan logam kolektif, antara lain.
Kesulitan ini dijelaskan oleh mekanik kuantum, kerana kedua -dua teori ini dan banyak pendekatan lain telah ditubuhkan berdasarkan model yang paling mudah dari satu elektron, sambil cuba memohon dalam struktur atom multielektronik yang lebih kompleks.
Rujukan
- Wikipedia. (2018). Wikipedia. Diambil dari.Wikipedia.org
- Holman, j. S., Dan batu, p. (2001). Kimia. Pulih dari buku.Google.co.Pergi
- Tempat letak kenderaan. (2010). Ikatan logam logam. Pulih dari buku.Google.co.Pergi
- Rohrer, g. S. (2001). Struktur dan ikatan dalam bahan kristal. Pulih dari buku.Google.co.Pergi
- Ibach, h., dan Lüth, h. (2009). Fizik Negeri Pepejal: Pengenalan kepada Prinsip Sains Bahan. Pulih dari buku.Google.co.Pergi

