Transaminasi
- 4549
- 1290
- Delbert Dare
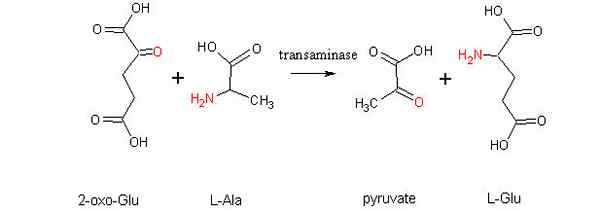
 Skim tindak balas aminotransference antara asid amino dan alpha-zoacid (sumber: Alcibiades melalui Wikimedia Commons)
Skim tindak balas aminotransference antara asid amino dan alpha-zoacid (sumber: Alcibiades melalui Wikimedia Commons) Apa itu transaminasi?
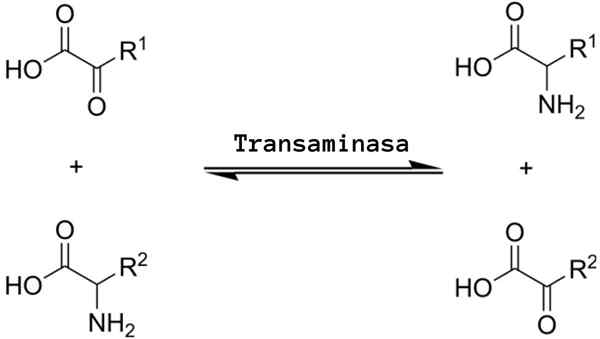
The Transaminasi Ia adalah sejenis tindak balas kimia yang berfungsi dalam "pengagihan semula" kumpulan asid amino, kerana ia mengelilingi proses aminasi yang boleh diterbalik dikenali sebagai transaminase atau aminotransferase.
Tindak balas transaminasi umum membayangkan pertukaran antara asid amino dan mana-mana α-zo-stoat, di mana pertukaran kumpulan amino menghasilkan versi ketoacid asid amino substrat pertama dan versi asid amino pertama substrat α-zo-ekotoasid.
Kumpulan amino yang biasanya ditukar adalah "alpha" amino, iaitu, yang mengambil bahagian dalam pembentukan pautan peptida dan yang mentakrifkan struktur asid amino, walaupun reaksi yang melibatkan kumpulan amino lain yang hadir dalam kedudukan yang berbeza dalam Kedudukan yang berbeza boleh berlaku di.
Dengan pengecualian lisin, treonine, proline dan hidroksiprolin, semua asid amino mengambil bahagian dalam tindak balas transaminasi, walaupun untuk histidin, serine, methodin dan phenylalanine telah diterangkan transaminase, tetapi laluan metabolik mereka tidak menyiratkan jenis reaksi ini.
Reaksi transaminasi antara asid amino dan α-cethoacids ditemui pada tahun 1937 oleh Braunstein dan Kritzmann, dan sejak itu mereka telah tertakluk kepada kajian yang sengit, kerana ia berlaku dalam banyak fabrik organisma yang berbeza dan dengan tujuan yang berbeza.
Pada manusia, sebagai contoh, transaminase diedarkan secara meluas dalam tisu badan dan sangat aktif dalam tisu otot jantung, di hati, dalam tisu otot rangka dan di buah pinggang.
Mekanisme tindak balas
Reaksi transaminasi menyiratkan lebih kurang mekanisme yang sama. Seperti yang disebutkan di atas, tindak balas ini berlaku sebagai pertukaran kumpulan amino antara asid amino dan α-zo-cid.
Boleh melayani anda: Bahan seramik: ciri, jenis, contohReaksi ini bergantung kepada sebatian yang dikenali sebagai pyridoxal fosfat, derivatif vitamin B6 yang mengambil bahagian sebagai pengangkut kumpulan amino dan yang mengikat enzim transaminase melalui pembentukan asas schiff antara kumpulan aldehid molekul ini dan ε-amino dari a ε-amino dari a ε-amino a sisa lysine di tapak aktif enzim.
Kesatuan antara pyridoxal fosfat dan residu lisin di tapak aktif tidak kovalen, tetapi diberikan melalui interaksi elektrostatik antara beban positif nitrogen dalam lisin dan beban negatif dalam kumpulan fosfat pyridoxal.
Dalam tindak balas, asid amino yang berfungsi sebagai substrat menggantikan kumpulan ε-amino residu lisin di tapak aktif yang mengambil bahagian dalam pangkalan Schiff dengan pyridoxal.
Sementara itu, sepasang elektron karbon alfa asid amino dikeluarkan dan dipindahkan ke cincin piridin yang membentuk pyridoxal fosfat (dengan caj positif) dan kemudian mereka "disampaikan" ke α-zo-zid yang berfungsi sebagai substrat kedua.
Dengan cara ini, fosfat pyridoxal bukan sahaja mengambil bahagian dalam pemindahan atau pengangkutan asid amino antara asid amino dan α-ekotoasid yang substrat transaminase, tetapi juga bertindak sebagai "tenggelam" elektron, memudahkan penyisihan hidrogen asid alfa.
Ringkasnya, substrat pertama, asid amino, memindahkan kumpulan amino ke pyridoxal fosfat, dari mana ia kemudiannya dipindahkan ke substrat kedua, α-zo-ekotoida, membentuk, dalam perantaraan, sebatian perantara yang dikenali sebagai pyridoxamine fosfat.
Boleh melayani anda: Kromatografi lajurFungsi transaminasi
Enzim transaminase biasanya terdapat di sitosol dan mitokondria dan berfungsi dalam integrasi laluan metabolik yang berbeza.
Glutamate dehydrogenase dalam reaksi songsang, contohnya, boleh menjadikan glutamat menjadi ammonium, NADH (atau NADPH) dan α-zetoglutarate, yang boleh memasuki kitaran asid trikarboksilat dan berfungsi dalam pengeluaran tenaga.
Enzim ini, yang berada dalam matriks mitokondria, mewakili titik cawangan yang mengaitkan asid amino dengan metabolisme tenaga, sehingga apabila sel tidak mempunyai tenaga yang mencukupi dalam bentuk karbohidrat atau lemak untuk berfungsi, ia dapat menggunakan beberapa asid amino untuk sama tujuan.
Pembentukan enzim (glutamat dehidrogenase) semasa perkembangan otak adalah penting untuk mengawal detoksifikasi ammonium, kerana telah ditunjukkan bahawa beberapa kes retardasi mental mempunyai kaitan dengan aktiviti yang rendah ini, yang membawa kepada pengumpulan ammonium, yang memudaratkan kesihatan otak.
Dalam beberapa tindak balas transaminasi sel hati juga boleh digunakan untuk sintesis glukoneogenesis glukosa.
Glutamin diubah menjadi glutamat dan ammonium oleh enzim glutaminase. Kemudian, glutamat diubah menjadi α-zetoglutarate, yang memasuki kitaran Krebs dan kemudian ke gluconeogenesis. Langkah terakhir ini berlaku terima kasih kepada Malo, salah satu produk di laluan, diangkut di luar mitokondria dengan cara pesawat ulang -alik.
Shuttle ini meninggalkan α-cethoglutarate pada belas kasihan enzim málica, yang menjadikannya piruvat. Dua molekul piruvat dapat ditukar, maka, molekul glukosa melalui gluconeogenesis.
Boleh melayani anda: kelalang latar belakang rataContoh
Reaksi transaminasi yang paling biasa berkaitan dengan asid amino alanine, asid glutamat dan asid aspartik.
Sesetengah enzim aminotransferase boleh, sebagai tambahan kepada pyridoxal fosfat, menggunakan piruvat sebagai "coenzyme", seperti halnya dengan transaminase glutamate-piruvate, yang memangkinkan reaksi berikut:
glutamat + piruvat ↔ alanine + α-cetoglutarate
Sel-sel otot bergantung kepada tindak balas ini untuk menghasilkan alanin dari piruvat dan mendapatkan tenaga melalui kitaran Krebs dengan cara α-zetoglutorat. Di dalam sel -sel ini penggunaan alanine sebagai sumber tenaga bergantung kepada penghapusan kumpulan amino sebagai ion ammonium di hati, melalui kitaran urea.
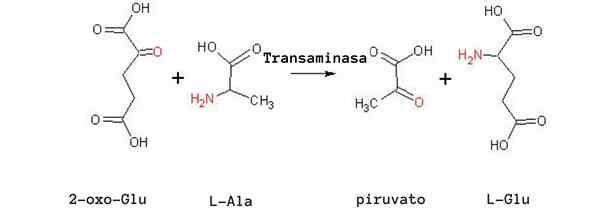 Reaksi Transaminasi Alanine (Sumber: Tomas Drab [Domain Awam] melalui Wikimedia Commons)
Reaksi Transaminasi Alanine (Sumber: Tomas Drab [Domain Awam] melalui Wikimedia Commons) Satu lagi tindak balas transaminasi yang sangat penting dalam spesies yang berbeza adalah yang dikatalisis oleh enzim aspartat aminotransferase:
L-spartato + α-ketoglutarate ↔ oxalacetate + l-glutamate
Akhirnya, tetapi sekurang-kurangnya, tindak balas transaminasi asid γ-aminobutyric (GABA), asid amino bukan protein untuk sistem saraf pusat yang berfungsi sebagai neurotransmitter menghalang. Reaksi ini dipangkin oleh asid transaminase γ-aminobutiri dan lebih kurang seperti berikut:
α-ketoglutarate + asid 4-aminobutanoik ↔ glutamat + semi-kereta succinic
Semi -penggunaan separuh succinic ditukar menjadi asid succinic oleh tindak balas pengoksidaan dan yang terakhir dapat memasuki kitaran Krebs untuk pengeluaran tenaga.

