Struktur, sifat, kegunaan dan risiko triethilamine

- 2219
- 521
- Dallas Bernhard
The Triethilamine Ia adalah sebatian organik, lebih tepatnya amina alifatik, yang formula kimianya adalah N (CH2Ch3)3 atau bersih3. Seperti amina cecair lain, ia membentangkan bau yang serupa dengan ammonia bercampur dengan ikan; Wapnya menjadikan bahan ini membosankan dan berbahaya tanpa pengekstrak atau pakaian yang sesuai.
Sebagai tambahan kepada formula masing -masing, ia biasanya disingkat ke sebatian ini sebagai ASD; Walau bagaimanapun, ini boleh menyebabkan kekeliruan dengan amina lain, seperti trietanolamine, N (Ethoh)3, atau tetraetilamonium, amina quaternary, bersih4+.
 Skeleton Triethylamine. Sumber: Campuran [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]
Skeleton Triethylamine. Sumber: Campuran [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]] Dari kerangka (imej unggul), boleh dikatakan bahawa triethylamine agak serupa dengan ammonia; Walaupun yang kedua mempunyai tiga hidrogen, NH3, Yang pertama mempunyai tiga kumpulan etil, N (CH2Ch3)3. Sintesisnya bermula dari rawatan ammonia cecair dengan etanol, yang berlaku alkilasi.
Jaring3 Anda boleh membentuk garam hygroscopic dengan HCl: triethilamine hydrochloride, bersih3· HCl. Di samping itu, beliau mengambil bahagian sebagai pemangkin homogen dalam sintesis ester dan amidas, jadi ia adalah pelarut yang diperlukan di makmal organik.
Juga, bersama -sama dengan reagen lain, ia membolehkan pengoksidaan alkohol primer dan sekunder kepada aldehid dan keton, masing -masing. Seperti ammonia adalah asas, dan oleh itu, ia boleh membentuk garam organik melalui tindak balas peneutralan.
[TOC]
Struktur triethylamine
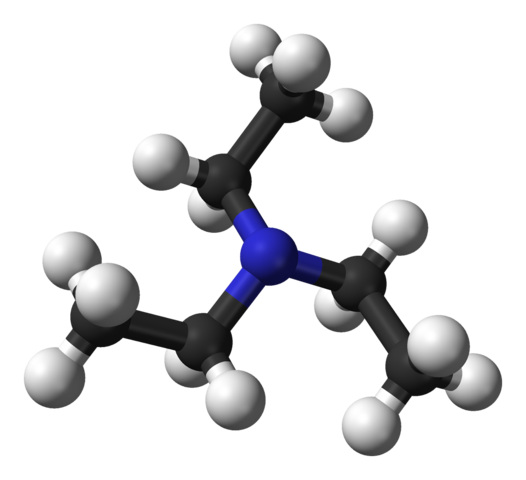 Struktur triethylamine. Sumber: Benjah-bmm27 [domain awam].
Struktur triethylamine. Sumber: Benjah-bmm27 [domain awam]. Imej atas menunjukkan struktur triethylamine dengan model sfera dan bar. Di tengah -tengah molekul atom nitrogen terletak, diwakili oleh sfera kebiruan; Dan dikaitkan dengannya, tiga kumpulan etil, seperti cabang kecil sfera hitam dan hitam.
Walaupun mereka tidak dengan mata kasar, pada atom nitrogen terdapat beberapa elektron yang tidak dikongsi bersama. Kedua -dua elektron dan tiga kumpulan -ch2Ch3 Mereka mengalami penolakan elektronik; Tetapi sebaliknya, mereka menyumbang untuk menentukan momen dipole molekul.
Boleh melayani anda: Cycloalcanos: sifat, reaksi, kegunaan, contohWalau bagaimanapun, momen dipole seperti itu lebih rendah daripada yang, contohnya, diethylamine, NHET2; Dan juga, ia tidak mempunyai kemungkinan membentuk jambatan hidrogen.
Ini kerana dalam triethylamine tidak ada ikatan N-H, dan akibatnya, gabungan kecil dan titik mendidih diperhatikan berbanding dengan amina lain yang berinteraksi dengan sedemikian.
Walaupun terdapat sedikit momen dipole, daya penyebaran antara kumpulan etil molekul bersih tidak dapat ditolak3 jiran. Menambah kesan ini, ia dibenarkan mengapa, walaupun triethylamine tidak menentu, ia mendidih sekitar 89ºC, terima kasih kepada jisim molekul yang agak besar.
Sifat
Penampilan fizikal
Cecair tanpa warna dengan bau ammonia dan ikan yang tidak menyenangkan.
Jisim molar
101,193 g/mol.
Takat didih
89ºC.
Takat lebur
-115ºC. Perhatikan betapa lemahnya daya intermolecular yang menyatukan molekul triethylamine dalam pepejal mereka.
Ketumpatan
0.7255 g/ml.
Kelarutan
Ia agak larut dalam air, 5.5 g/100g pada 20ºC. Di bawah 18.7 ºC, menurut PubChem, bahkan boleh didapati dengan ini.
Di samping "bersaing" dengan air, ia juga larut dalam aseton, benzena, etanol, eter, dan parafin.
Ketumpatan wap
3.49 berhubung dengan udara.
Tekanan wap
57.07 mmHg pada 25ºC.
Henry Constant
66 μmol/PA · kg.
titik pencucuhan
-15ºC.
Suhu sendiri
312ºC.
Kapasiti haba
216.43 kJ/mol.
Haba pembakaran
10.248 kapur/g.
Haba pengewapan
34.84 kJ/mol.
Ketegangan permukaan
20.22 N/M A 25ºC.
Indeks refraktif
1,400 hingga 20ºC.
Goo
0.347 MPa · s pada 25ºC.
Asas pemalar
Trietilamine mempunyai PKB sama dengan 3.25.
Asas
Asas untuk amina ini dapat dinyatakan oleh persamaan kimia berikut:
Boleh melayani anda: polimer sintetikJaring3 + Ha nhet3+ + Ke-
Di manakah spesies asid yang lemah. Pasangan NHET3+Ke- Ia membentuk apa yang menjadi garam ammonium tersier.
Asid konjugasi NHET3+ Ia lebih stabil daripada ammonium, NH4+, Kerana tiga kumpulan etil mendermakan sebahagian daripada ketumpatan elektronik mereka untuk mengurangkan beban positif pada atom nitrogen; Oleh itu, triethylamine lebih asas daripada ammonia (tetapi kurang asas daripada oh-).
Aplikasi
 Reaksi yang dikatalisis oleh triethylamine. Sumber: Tachymètre [domain awam].
Reaksi yang dikatalisis oleh triethylamine. Sumber: Tachymètre [domain awam]. Asas, dalam kes ini, nukleofiliti triethylamine digunakan untuk memangkin sintesis ester dan amida dari substrat biasa: acyl chloride, rcocl (imej unggul).
Di sini, pasangan bebas elektron nitrogen menyerang kumpulan karbonyl, membentuk perantara; yang, secara berturut -turut, diserang oleh alkohol atau amina untuk membentuk ester atau amida,.
Dalam baris pertama imej mekanisme yang mengikuti tindak balas untuk menghasilkan ester divisualisasikan, sementara baris kedua sepadan dengan amida. Perhatikan bahawa dalam kedua -dua reaksi triethylamine hydrochloride berlaku, bersih3· HCl, dari mana pemangkin dipulihkan untuk memulakan kitaran lain.
Polimer
Nukleofiliti triethylamine juga digunakan untuk menambah polimer tertentu, menyembuhkan mereka dan memberi mereka lebih besar. Sebagai contoh, ia adalah sebahagian daripada sintesis resin polikarbonat, busa poliuretana dan resin epoksi.
Kromatografi
Amphifilicity dan volatilitasnya yang jauh membolehkan garam yang diperolehnya digunakan sebagai reagen dalam kromatografi pertukaran ion. Satu lagi penggunaan triethylemine yang tersirat ialah beberapa garam amina tertiari boleh diperolehi daripadanya, seperti triethylamine bikarbonat, NHET3HCO3 (atau TEAB).
Boleh melayani anda: kalorimetri: apa kajian dan aplikasiProduk komersial
Ia telah digunakan sebagai bahan tambahan dalam perumusan rokok dan tembakau, pengawet makanan, lantai, perisa, racun perosak, pewarna, dll.
Risiko
Wap triethylamine bukan sahaja tidak menyenangkan tetapi berbahaya, kerana mereka dapat merengsakan hidung, tekak dan paru -paru menyebabkan edema pulmonari atau bronkitis. Begitu juga, lebih padat dan berat dari udara, mereka tetap berada di aras tanah, bergerak ke sumber haba yang mungkin untuk meletup.
Bekas cecair ini mestilah jauh dari api kerana mereka mewakili bahaya letupan yang akan berlaku.
Di samping itu, hubungan dengan spesies atau reagen seperti: logam alkali, asid tricloroacetic, nitrat, asid nitrik (kerana ia akan membentuk nitrosoamines, sebatian karsinogen), asid kuat, peroksida dan permanganates.
Anda tidak boleh menyentuh aluminium, tembaga, zink atau aloi, kerana ia mempunyai keupayaan untuk menghancurkannya.
Mengenai hubungan fizikal, ia boleh menyebabkan ruam alahan dan kulit jika pendedahan itu akut. Sebagai tambahan kepada paru -paru, ia boleh menjejaskan hati dan buah pinggang. Dan mengenai hubungan okular, ia menyebabkan kerengsaan, yang bahkan dapat merosakkan mata jika mereka tidak dirawat atau dibersihkan pada waktunya.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2019). Triethylamine. Diperoleh dari: dalam.Wikipedia.org
- Merck. (2019). Triethylamine. Pulih dari: sigmaaldrich.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Triethylamine. Pangkalan data PUBCHEM. CID = 8471. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Rangkaian data toksikologi. (s.F.). Triethylamine. Pulih dari: toksnet.NLM.NIH.Gov
- Jabatan Kesihatan New Jersey. (2010). Triethylamine. Pulih dari: NJ.Gov
- « 10 Curiosities Mengenai Zaman Pertengahan yang Akan Mengejutkan Anda
- Struktur Alkohol Isoamilico, Hartanah, Kegunaan dan Risiko »

