Struktur, So3) Struktur, Harta, Risiko, Kegunaan Sulfur (SO3)
- 2173
- 405
- Delbert Dare
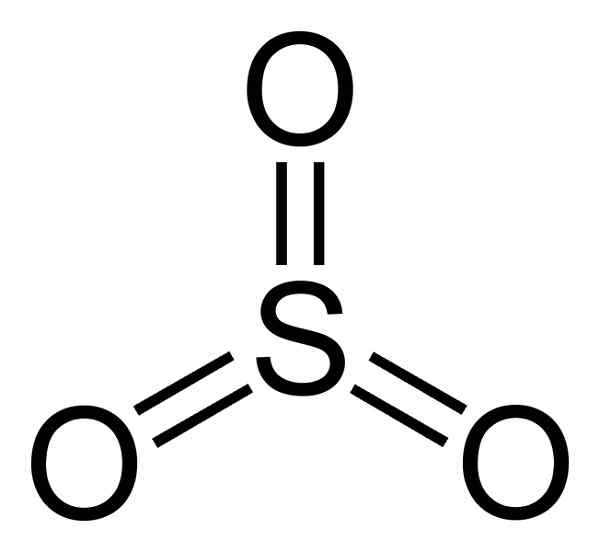
Dia Sulfur trioksida Ia adalah sebatian bukan organik yang dibentuk oleh kesatuan atom sulfur dan 3 atom oksigen (O). Formula molekulnya begitu3. Pada suhu bilik, begitu3 Ia adalah cecair yang mengeluarkan gas di udara.
Struktur SO SO3 Gaseous rata dan simetri. Tiga oksigen terletak sama rata di sekitar belerang. So3 Bertindak balas dengan ganas dengan air. Tindak balasnya adalah eksotermik, yang bermaksud bahawa haba dihasilkan, dengan kata lain, banyak dipanaskan.
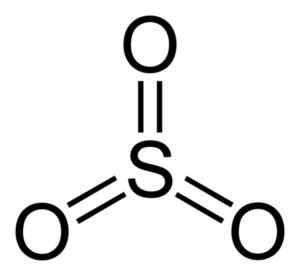 Molekul sulfur trioksida jadi3. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons.
Molekul sulfur trioksida jadi3. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons. Bila SO3 Cecair sejuk, ia menjadi pepejal yang boleh mempunyai tiga jenis struktur: alpha, beta dan gamma. Yang paling stabil adalah alpha, dalam bentuk lapisan bersama antara satu sama lain yang membentuk rangkaian.
Gaseous Sulfur Trioxide digunakan untuk menyediakan asid sulfurik merokok, juga dipanggil minyak, kerana minyak atau persamaan bahan berminyaknya. Satu lagi aplikasi pentingnya adalah dalam sulphonasi sebatian organik, iaitu penambahan kumpulan -so3- kepada ini. Oleh itu, bahan kimia yang berguna boleh disediakan seperti detergen, pewarna, racun perosak, antara yang lain.
So3 Ia sangat berbahaya, ia boleh menyebabkan luka bakar, mata dan kerosakan kulit yang serius. Juga tidak boleh dihirup atau ditelan kerana ia boleh menyebabkan kematian oleh luka bakar dalaman, di dalam mulut, esofagus, perut, dll.
Atas sebab -sebab ini, ia mesti dimanipulasi dengan berhati -hati. Anda tidak boleh menghubungi air atau bahan mudah terbakar seperti kayu, kertas, kain, dll., Nah, api dapat dihasilkan. Dan tidak sepatutnya dibuang atau pembetung kerana bahaya letupan.
So3 Gaseous yang dihasilkan dalam proses perindustrian tidak boleh dilepaskan ke alam sekitar, kerana ia adalah salah satu yang bertanggungjawab untuk hujan asid yang telah merosakkan sambungan hutan yang besar di dunia.
[TOC]
Struktur
Molekul sulfur trioksida begitu3 Dalam keadaan gas ia mempunyai struktur segi tiga rata.
Ini bermakna bahawa kedua -dua belerang dan tiga oksigen terdapat dalam satah yang sama. Di samping itu, pengedaran oksigen dan semua elektron adalah simetri.
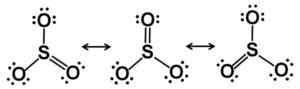 Lewis Resonance Starcutures. Elektron diedarkan secara adil3. Pengarang: Marilú Stea.
Lewis Resonance Starcutures. Elektron diedarkan secara adil3. Pengarang: Marilú Stea. Dalam keadaan pepejal tiga jenis struktur SO diketahui3: Alfa (α-so3), beta (β-so3) dan gamma (γ-so3).
Bentuk gamma γ-so3 Mengandungi perapi kitaran, iaitu, tiga unit SO3 bersama -sama membentuk molekul berbentuk kitaran atau cincin.
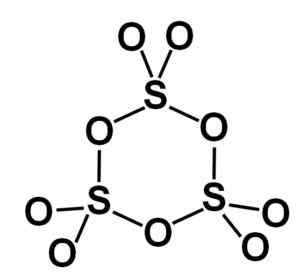 Molekul cincin gamma jenis trioksida sulfur pepejal. Pengarang: Marilú Stea.
Molekul cincin gamma jenis trioksida sulfur pepejal. Pengarang: Marilú Stea. Fasa beta β-so3 Ia mempunyai rantaian helical tetrahedra komposisi yang tidak terhingga4 bersatu antara satu sama lain.
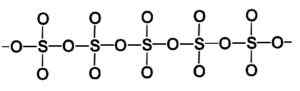 Struktur beta jenis sulfur trioksida pepejal. Pengarang: Marilú Stea.
Struktur beta jenis sulfur trioksida pepejal. Pengarang: Marilú Stea. Cara yang paling stabil ialah alpha α-so3, Sama dengan beta tetapi dengan struktur lapisan, dengan rantai bersatu membentuk rangkaian.
Nomenclature
-Sulfur trioksida
-Sulfurik anhydride
-Sulfurik oksida
-SW3 Gamma, γ-so3
-SW3 beta, β-so3
-SW3 Alfa, α-so3
Ciri-ciri fizikal
Keadaan fizikal
Pada suhu bilik (sekitar 25 ºC) dan tekanan atmosfera, SO3 Ia adalah cecair tanpa warna yang memancarkan asap di udara.
Bila SO3 Cecair murni pada 25 ºC adalah campuran begitu3 monomerik (satu molekul) dan trimerik (3 molekul terikat) formula s3Sama ada9, Juga dipanggil SO3 Gamma γ-so3.
Boleh melayani anda: Skala Rankine: Apa, Penukaran, ContohApabila menurunkan suhu, jika begitu3 Ia adalah murni apabila mencapai 16.86 ºC, ia menguatkan atau membeku γ-so3, juga dipanggil "jadi ais3".
Sekiranya ia mengandungi sedikit kelembapan (walaupun jejak atau kuantiti yang sangat kecil)3 Memolimisikan beta β-so3 yang membentuk kristal dengan kecerahan sutera.
Kemudian lebih banyak kesatuan dibentuk dengan menghasilkan struktur α-so3, yang merupakan pepejal kristal dalam bentuk jarum yang menyerupai asbestos atau asbestos.
Apabila alpha dan beta cair menjana gamma.
Berat molekul
80.07 g/mol
Takat lebur
SW3 Gamma = 16.86 ºC
Triple Point
Ia adalah suhu di mana tiga keadaan fizikal hadir: pepejal, cecair dan gas. Dalam bentuk alpha titik triple berada pada 62.2 ºC dan dalam beta ia berada pada 32.5 ºC.
Dengan memanaskan borang alpha ini mempunyai kecenderungan yang lebih besar untuk menyemai daripada mencairkan. Sublimimar bermaksud bergerak dari keadaan pepejal ke soda secara langsung, tanpa melalui keadaan cecair.
Takat didih
Semua bentuk SO3 Rebus pada 44.8 ºC.
Ketumpatan
So3 Cecair (gamma) mempunyai ketumpatan 1,9225 g/cm3 pada 20 ºC.
So3 Gaseous mempunyai ketumpatan sebanyak 2.76 berbanding udara (udara = 1), menunjukkan bahawa ia lebih berat daripada udara.
Tekanan wap
SW3 Alfa = 73 mm hg pada 25 ºC
SW3 beta = 344 mm Hg pada 25 ° C
SW3 Gamma = 433 mm hg pada 25 ºC
Ini bermaksud bahawa bentuk gamma cenderung menguap lebih mudah daripada beta dan ini bahawa alpha.
Kestabilan
Bentuk Alpha adalah struktur yang paling stabil, yang lainnya metastable, iaitu, mereka kurang stabil.
Sifat kimia
So3 Reacts Energetically dengan air untuk memberikan asid sulfurik h2SW4. Apabila bertindak balas di sana sangat panas sehingga wap air cepat terpisah dari campuran.
Terdedah kepada udara3 menyerap kelembapan dengan cepat, memancarkan wap padat.
Ini adalah ejen dehidrasi yang sangat kuat, ini bermaksud bahawa ia menghilangkan air dengan mudah dari bahan lain.
Sulfur SO3 Ia mempunyai pertalian untuk elektron bebas (iaitu, elektron yang tidak berada dalam hubungan antara dua atom) sehingga ia cenderung membentuk kompleks dengan sebatian yang memiliki mereka seperti piridin, trimethylamine atau dioksana.
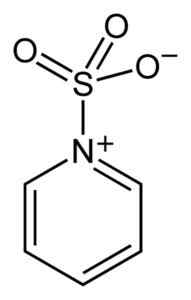 Kompleks antara sulfur trioksida dan piridin. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Kompleks antara sulfur trioksida dan piridin. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Dengan membentuk kompleks, belerang mengambil "meminjam" elektron kompaun lain untuk memenuhi kekurangan mereka. Sulfur trioksida masih terdapat di kompleks ini, yang digunakan dalam tindak balas kimia untuk menyediakannya3.
Ia adalah reagen sulfonan yang kuat dari sebatian organik, yang bermaksud bahawa ia berfungsi dengan mudah menambah kumpulan -so3- Kepada molekul.
Ia bertindak balas dengan mudah dengan oksida banyak logam untuk memberikan sulfat logam ini.
Ia menghakis ke arah logam, tisu haiwan dan tumbuhan.
So3 Ia adalah bahan yang sukar untuk dikendalikan untuk beberapa sebab: (1) titik mendidihnya agak rendah, (2) mempunyai kecenderungan untuk membentuk polimer pepejal pada suhu kurang dari 30 ºC dan (3) mempunyai kereaktifan yang tinggi ke arah hampir semua bahan organik Dan air.
Boleh melayani anda: pepejal amorf: struktur, sifat, contohIa boleh polimerisasi secara meletup jika tidak mengandungi penstabil dan terdapat kehadiran kelembapan. Sebagai penstabil, dimetilsulfat atau boron oksida digunakan.
Memperoleh
Ia diperolehi oleh tindak balas pada 400 ºC antara sulfur dioksida sehingga2 dan oksigen molekul atau2. Walau bagaimanapun, tindak balasnya sangat perlahan dan pemangkin diperlukan untuk meningkatkan kelajuan ini.
2 Jadi2 + Sama ada2 ⇔ 2 Jadi3
Antara sebatian yang mempercepatkan tindak balas ini ialah Pt Plato Pt, vanadium pentoxide v2Sama ada5, Ferric Oxide2Sama ada3 dan nitrik oksida.
Aplikasi
Dalam penyediaan minyak
Salah satu aplikasi utamanya terdiri daripada penyediaan asid sulfurik minyak atau asap, dipanggil kerana ia memancarkan wap yang kelihatan ke mata kasar. Untuk mendapatkannya, SO diserap3 Dalam asid sulfurik pekat h2SW4.
 Pu -sulfuric oleum atau merokok. Anda dapat melihat asap putih keluar dari botol. W. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Pu -sulfuric oleum atau merokok. Anda dapat melihat asap putih keluar dari botol. W. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Ini dilakukan di menara keluli tahan karat khas di mana asid sulfurik pekat (yang cair)3 Gaseous akan naik.
Cecair dan gas bersentuhan dan bergabung, membentuk oleum yang merupakan cecair penampilan berminyak. Ini mempunyai campuran h2SW4 Dan juga3, Tetapi ia juga mempunyai molekul asid disulfurik h2S2Sama ada7 dan trisulfuric h2S3Sama ada10.
Dalam tindak balas sulfoni kimia
Sulfonasi adalah proses utama dalam aplikasi perindustrian skala besar untuk pembuatan detergen, surfaktan, pewarna, racun perosak dan produk farmaseutikal.
So3 Ia berfungsi sebagai ejen sulfonan untuk menyediakan minyak sulfon dan detergen alkil-angal-sulfon, antara banyak sebatian lain. Berikut adalah tindak balas sulfonasi sebatian aromatik:
Arh + So3 → Arso3H
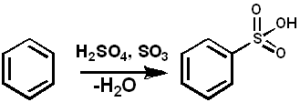 Benzene sulphonation dengan begitu3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Benzene sulphonation dengan begitu3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Untuk tindak balas sulfonasi, oleum atau sebagainya boleh digunakan3 Dalam bentuk kompleksnya dengan piridin atau trimethylamine, antara lain.
Dalam pengekstrakan logam
Gas s3 Ia telah digunakan dalam rawatan mineral. Oksida logam mudah boleh menjadi sulfat yang lebih larut apabila merawatnya dengan begitu3 pada suhu yang agak rendah.
Galian belerang seperti pirit (besi sulfida), saluran3 Membolehkan logam ini dengan mudah dan kos rendah.
Besi, nikel dan sulfida tembaga bertindak balas dengan gas3 Walaupun pada suhu bilik, membentuk sulfat masing -masing, yang sangat larut dan boleh dikenakan proses lain untuk mendapatkan logam tulen.
Dalam beberapa kegunaan
So3 Ia berfungsi untuk menyediakan asid chlorosulfuric juga dipanggil asid chlorosulfonic HSO3Cl.
Sulfur trioksida adalah oksidan yang sangat kuat dan digunakan dalam pembuatan letupan.
Risiko
Untuk kesihatan
So3 Ia adalah sebatian yang sangat toksik oleh semua laluan, iaitu, penyedutan, pengambilan dan hubungan kulit.
IRRITA DAN CORRODES Membran Mukus. Menyebabkan kulit dan mata. Wapnya sangat toksik apabila mereka dihirup. Pembakaran dalaman dihasilkan, kesukaran bernafas, sakit dada dan edema pulmonari.
Boleh melayani anda: butanone: struktur, sifat dan kegunaan Sulfur trioksida SO3 sangat menghakis dan berbahaya. Pengarang: Openicons. Sumber: Pixabay.
Sulfur trioksida SO3 sangat menghakis dan berbahaya. Pengarang: Openicons. Sumber: Pixabay. Ia beracun. Pengambilannya menghasilkan luka bakar, esofagus dan perut yang teruk. Di samping itu, disyaki bahawa ia adalah karsinogen.
Kebakaran atau letupan
Ia mewakili bahaya kebakaran ketika bersentuhan dengan bahan organik seperti kayu, serat, kertas, minyak, kapas, antara lain, terutama jika mereka basah.
Terdapat juga risiko jika anda bersentuhan dengan pangkalan atau pengurangan ejen. Ia digabungkan dengan air yang meletup, membentuk asid sulfurik.
Hubungi dengan logam boleh menghasilkan gas hidrogen h2 yang sangat mudah terbakar.
Ia harus dielakkan di dalam kapal kaca untuk mengelakkan kemungkinan pecahnya kekerasan.
Kesan alam sekitar
So3 Ia dianggap sebagai salah satu bahan pencemar terbesar yang ada di atmosfera bumi. Ini disebabkan oleh peranannya dalam pembentukan aerosol dan sumbangannya kepada hujan asid (kerana pembentukan asid sulfurik h2SW4).
 Hutan yang rosak oleh hujan asid di Republik Czech. Lovecz [domain awam]. Sumber: Wikimedia Commons.
Hutan yang rosak oleh hujan asid di Republik Czech. Lovecz [domain awam]. Sumber: Wikimedia Commons. So3 Ia terbentuk di atmosfera kerana pengoksidaan sulfur dioksida sehingga2. Apabila SO terbentuk3 Ini bertindak balas dengan cepat dengan air untuk membentuk asid sulfurik h2SW4. Menurut kajian baru -baru ini, terdapat mekanisme transformasi SOS lain3 Di atmosfera, tetapi disebabkan oleh banyak air yang ada dalam satu ini, SO masih dipertimbangkan3 Terutamanya ditukar kepada h2SW4.
So3 sisa gas gas atau industri yang mengandungi ia tidak boleh dimuat turun ke atmosfera kerana ia adalah bahan pencemar berbahaya. Ia adalah gas yang sangat reaktif dan, seperti yang telah dikatakan di atas, dengan kehadiran kelembapan udara3 Ia menjadi asid sulfurik h2SW4. Oleh itu, di udara SO3 berterusan dalam bentuk asid sulfurik yang membentuk titisan kecil atau aerosol.
Jika titisan asid sulfurik memasuki saluran pernafasan manusia atau haiwan, mereka tumbuh dengan cepat kerana kelembapan hadir di sana, sehingga mereka mempunyai kemungkinan menembusi paru -paru. Salah satu mekanisme oleh kabus asid H2SW4 (Itu begitu3) Ia boleh menghasilkan ketoksikan yang kuat adalah kerana pH organisma hidup ekstrasel dan intraselular (tumbuhan, haiwan dan manusia) berubah).
Menurut beberapa penyelidik, jadi kabut3 Ini adalah punca peningkatan asma di kawasan Jepun. Kabus begitu3 Ia mempunyai kesan yang sangat menghakis terhadap logam, jadi struktur logam yang dibina oleh manusia seperti beberapa jambatan dan pembinaan dapat sangat terjejas.
So3 cecair tidak boleh dibuang di dalam saliran air kotor atau pembetung. Sekiranya ia dicurahkan ke dalam pembetung, anda boleh membuat kebakaran atau bahaya letupan. Sekiranya ia tumpah secara tidak sengaja, aliran air tidak boleh diarahkan ke arah produk. Ia tidak boleh diserap dalam habuk papan atau bahan api penyerap lain, kerana ia dapat menghasilkan kebakaran.
Ia harus diserap di pasir kering, tanah kering atau penyerap lengai yang sama sekali kering. So3 Ia tidak boleh dicurahkan ke dalam alam sekitar dan tidak boleh berhubung dengan ini. Ia harus disimpan jauh dari sumber air kerana dengan ini menghasilkan asid sulfurik yang berbahaya kepada organisma akuatik dan tanah.
Rujukan
- Sarkar, s. et al. (2019). Pengaruh ammonia dan air pada nasib sulfur trioksida di troposfera: penyelidikan teoritis asid sulfamik dan jalur pembentukan asid sulfurik. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI pulih.NLM.NIH.Gov.
- Muller, t.L. (2006). Asid sulfurik dan sulfur trioksida. Kirk-Othmer Ensiklopedia Teknologi Kimia. Jilid 23. Diperolehi dari perpustakaan dalam talian.Wiley.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Sulfur trioksida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kikuchi, r. (2001). Pengurusan alam sekitar sulfur trioksida sulfur: kesan SO3 Mengenai kesihatan manusia. Pengurusan Alam Sekitar (2001) 27: 837. Pautan pulih.Springer.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Ismail, m.Yo. (1979). Pengekstrakan logam dari sulfida menggunakan sulfur trioksida di tempat tidur cair. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Diperolehi dari perpustakaan dalam talian.Wiley.com.
- « Malawi Lago Geografi, Geologi, Kepentingan, Fauna, Rios
- Struktur, sifat natrium sianida (NACN), Risiko, Kegunaan »

