Struktur, sifat natrium sianida (NACN), Risiko, Kegunaan

- 4070
- 575
- Ismael Turner
Dia Natrium sianida Ia adalah garam tak organik yang dibentuk oleh natrium na+ dan anion sianida CN-. Formula kimianya adalah NACN. Juga dikenali sebagai natrium sianida, ia adalah pepejal kristal putih. Ia adalah hygroscopic, iaitu, ia menyerap air dari alam sekitar, dan kristalnya adalah kubik seperti natrium klorida NaCl.
Apabila melarutkan air, ia cenderung membentuk sianida hidrogen HCN. Penyelesaiannya membubarkan emas dan perak dengan mudah. Ciri ini menjadikannya digunakan untuk mengekstrak emas dan perak dari mineralnya. Penyelesaian yang digunakan untuk tujuan ini dikitar semula, iaitu, mereka digunakan semula beberapa kali.
 Natrium Natrium Sodium Cyanide. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Natrium Natrium Sodium Cyanide. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Walau bagaimanapun, sesetengah sianida berjaya melarikan diri dari kolam sisa tertentu, yang mewakili bahaya kepada fauna dan manusia, kerana sianida sangat toksik dan boleh menyebabkan kematian.
NACN digunakan dalam industri kimia sebagai perantara untuk menyediakan beberapa jenis sebatian, seperti pewarna, bahan kimia untuk pertanian dan ubat atau ubat -ubatan.
Natrium sianida adalah sebatian yang sangat berbahaya kerana ia boleh menyebabkan kematian, jadi ia mesti dimanipulasi dengan berhati -hati.
[TOC]
Struktur
Natrium sianida dibentuk oleh ion Na+ dan ion Cn-.
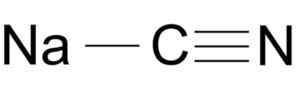 Struktur molekul sodium sianida NACN. Arrowsmaster [Domain Awam], Sumber: Wikimedia Commons.
Struktur molekul sodium sianida NACN. Arrowsmaster [Domain Awam], Sumber: Wikimedia Commons. Ion sianida mempunyai kereta kereta dan salah satu nitrogen bersatu dengan satu sama lain dengan pautan triple.
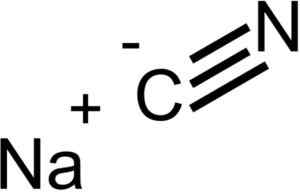 Ion yang membentuk nacn sianida nacn. EPOP [Domain Awam]. Sumber: Wikimedia Commons.
Ion yang membentuk nacn sianida nacn. EPOP [Domain Awam]. Sumber: Wikimedia Commons. NACN mempunyai struktur kristal yang sama seperti NaCl, jadi kristalnya adalah padu.
Nomenclature
-Natrium sianida
-Natrium sianida
Sifat
Keadaan fizikal
Pepejal kristal putih hygroscopic (menyerap air dari persekitaran).
Berat molekul
49,007 g/mol
Takat lebur
563.7 ºC
Takat didih
1496 ºC
Titik kilat
Ia tidak mudah terbakar. Tetapi jika ia terdedah kepada kebakaran, HCN hidrogen sianida dan oksida nitrogen berlaku.
Boleh melayani anda: sublimasi: konsep, proses dan contohKetumpatan
1,595 g/cm3 pada 20 ºC
Kelarutan
Sangat larut dalam air: 48 g/100 ml pada 10ºC, 82 g/100 ml pada suhu 35 ° C. Sedikit larut dalam alkohol
Pemisahan pemalar
Ia dihidrolisiskan dalam larutan berair yang menjana sianida hidrogen HCN. Pemalar hidrolisis ini adalah kh = 2.5 x 10-5.
Ph
Penyelesaian berair NaCn sangat beralkali
Sifat kimia
Semasa melarutkan air, ia memisahkan ionnya+ dan CN-. Dalam larutan akueus ion sianida CN- Ambil proton h+ air h2Atau membentuk HCN dan oh ion-, Jadi penyelesaiannya menjadi alkali.
CN- + H2O → hcn + oh-
Atas sebab ini, penyelesaian berair mereka terurai dengan cepat dengan tersimpan, membentuk HCN Hydrogen Cyanide.
Ia menghakis ke arah aluminium. Penyelesaiannya dengan mudah membubarkan AU dan perak AG dengan kehadiran udara.
Ia adalah ejen chelating kerana anion sianida CN- Ia boleh dengan mudah menyertai logam lain, seperti perak, emas, merkuri, zink, kadmium, dll.
Membentangkan bau badam pahit yang lemah.
Risiko
Mesti ditangani dengan teliti. Ia adalah sebatian yang sangat beracun, menghalang proses metabolik yang penting, dan menyebabkan kematian baik untuk pengambilan, penyedutan, penyerapan kulit atau hubungan mata.
Sekiranya NACN dihirup, ia larut dalam mukosa saluran pernafasan dan berlalu ke aliran darah. Ion sianida NACN mempunyai pertalian yang kuat untuk besi dalam keadaan pengoksidaan +3, iaitu, iman kation ferrik3+.
Apabila sianida diserap, ia bertindak balas dengan cepat dengan iman3+ enzim penting mitokondria sel (sitokrom oksidase), menghalang proses pernafasan tertentu daripada dijalankan.
Oleh itu, pernafasan selular dihalang atau brek dan hipoksia sitotoksik. Ini bermaksud bahawa sel dan tisu tidak dapat menggunakan oksigen, terutama sel otak dan jantung.
Dengan cara ini, kerosakan kekal atau maut pada badan berlaku. Ini boleh berlaku pada manusia dan haiwan.
Sekiranya kesesakan saluran darah dan kakisan mukosa gastrik sedang meminum, sebagai tambahan kepada apa yang telah disebutkan.
Boleh melayani anda: Justus von Liebig Natrium sianida naCn boleh menyebabkan kematian. Pengarang: Openicons. Sumber: Pixabay.
Natrium sianida naCn boleh menyebabkan kematian. Pengarang: Openicons. Sumber: Pixabay. Ia bukan bahan api, tetapi bersentuhan dengan asid, ia melepaskan HCN yang sangat mudah terbakar dan toksik.
Sekiranya ia cair dengan nitrit atau klorat, ia boleh mengeksploitasi.
Memperoleh
Ia boleh didapati dengan natrium NA, ammonia NH3 dan arang batu c. Natrium bertindak balas dengan ammonia yang memberikan natrium nanh2:
2 Na + 2 nh3 → 2 nanh2 + H2↑
Natrium amida dipanaskan dengan karbon pada 600 ºC dan menghasilkan natrium cyanamide na2NCN, yang kemudian dengan arang batu pada 800 ° C menjadi natrium sianida:
2 nanh2 + C → 2 jam2↑ + na2Ncn
Na2NCN + C → 2 NACN
Kaedah lain ialah mencairkan kalsium dan cyanamide arang batu dengan natrium karbonat na2Co3:
CANCN + C + NA2Co3 → Caco3 + 2 NACN
Ia juga boleh disediakan dengan lulus gas nitrogen n2 untuk campuran panas natrium karbonat2Co3 dan arang batu C serbuk, menggunakan iman iman sebagai pemangkin atau pemecut reaksi:
Na2Co3 + 4 c + n2 → 2 NACN + 3 CO ↑
Aplikasi
Dalam pengekstrakan mineral emas dan perak. Akibat
Natrium sianida telah digunakan untuk masa yang lama untuk mengeluarkan logam emas dan perak dari mineralnya.
Sianida yang digunakan dalam proses dikitar semula, tetapi sesuatu yang melarikan diri dari kolam sisa bersama dengan logam berat yang tidak pulih.
Burung, kelawar dan haiwan lain yang minum dari lagun ini dengan sianida telah diracun.
Terdapat rekod empangan Romania yang menyimpan kolam sisa terpencil dan rosak oleh peristiwa cuaca.
Akibatnya, tan sianida dibebaskan ke Sungai Sasar dan sistem akuifer yang berdekatan seperti Lapus, Somes, Tisza Rivers, berakhir di Danube.
Ini menyebabkan air terjun kematian haiwan, atau dengan kata lain, bencana ekologi.
 Pengekstrakan emas dengan sianida di New Zealand sekitar tahun 1918. Anda dapat melihat jumlah air yang tercemar, yang dilepaskan di sungai berdekatan. Perpustakaan Negara NZ di Commons [Tiada sekatan]. Sumber: Wikimedia Commons.
Pengekstrakan emas dengan sianida di New Zealand sekitar tahun 1918. Anda dapat melihat jumlah air yang tercemar, yang dilepaskan di sungai berdekatan. Perpustakaan Negara NZ di Commons [Tiada sekatan]. Sumber: Wikimedia Commons. Dalam pengeluaran sebatian kimia lain
Sodium Cyanide NaCn digunakan dalam sintesis pelbagai jenis sebatian organik.
Boleh melayani anda: Natrium oksida (Na2O): Struktur, formula, sifat, risikoSebagai contoh, pigmen dan pewarna disediakan (termasuk pengilat optik), sebatian untuk digunakan dalam bidang pertanian atau agrokimia dan pelbagai produk farmaseutikal.
Ia juga berfungsi untuk mendapatkan ejen chelating atau penculikan ion logam.
Dengan natrium sianida, sebatian yang dipanggil nitril disediakan, yang apabila dirawat dengan asid asid atau larutan berair alkali membolehkan untuk mendapatkan asid karboksilik.
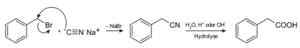 Penyediaan asid karboksilik menggunakan NACN Natrium Cyanide. Roland Mattern [domain awam]. Sumber: Wikimedia Commons.
Penyediaan asid karboksilik menggunakan NACN Natrium Cyanide. Roland Mattern [domain awam]. Sumber: Wikimedia Commons. Ia membolehkan untuk menyediakan asid lemak dengan kumpulan cyano, sianida logam berat dan hidrogen sianida HCN.
Dalam industri logam
NACN digunakan dalam penyelesaian yang digunakan dalam elektrod galvanoplasti atau logam (salutan logam dengan orang lain) contohnya zink.
Ia adalah komponen keluli keras. Ia juga berfungsi dalam pembersihan logam.
Dalam kegunaan lain
Natrium Cyanide adalah perantara dalam pembuatan nilon.
Ia digunakan untuk memisahkan mineral dengan pengapungan dengan buih.
Aplikasi tidak digunakan, dipersoalkan atau sangat jarang
Bangsa ini digunakan untuk menghapuskan tikus, seperti arnab dan tikus dan lubang mereka, dan menamatkan sarang rayap.
Ia kini digunakan sekali -sekala untuk menghapuskan coyotes, rubah dan anjing liar. Ia digunakan dalam bentuk kapsul sebagai dos mudah atau berbilang di tanah ragut, memburu dan hutan.
Kerana ketoksikan yang melampau, NACN mesti digunakan hanya oleh orang yang disediakan.
Penggunaan ini dianggap sangat berbahaya bagi manusia, tetapi ada yang masih menggunakannya.
 Kehidupan liar tidak boleh dihapuskan, kerana haiwan ini sudah berjuang untuk bertahan dalam keadaan yang sukar. Pengarang: MaxWDHS. Sumber: Pixabay.
Kehidupan liar tidak boleh dihapuskan, kerana haiwan ini sudah berjuang untuk bertahan dalam keadaan yang sukar. Pengarang: MaxWDHS. Sumber: Pixabay. Dalam bidang pertanian sebelum ini digunakan untuk memusnahkan pokok buah sitrus dan buah -buahan lain. Ia juga digunakan sebagai racun serangga dan miticide (penghapusan hama) yang akan digunakan selepas penuaian, untuk sitrus yang tidak ditetapkan atau untuk pengasingan trak yang digunakan untuk mengangkut mereka. Ia juga digunakan untuk mengepam kapal, kereta api dan gudang.
Semua kegunaan ini telah dipersoalkan oleh ketoksikan yang tinggi dari natrium sianida. Atas sebab ini, ia tidak lagi digunakan atau hanya jarang dan di bawah keadaan yang sangat terkawal.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Natrium sianida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia. Edisi keempat. John Wiley & Sons.
- Hurst, h.Dan. dan Martin, m.D. (2017). Toksikologi. Cyanide. Dalam Farmakologi dan Terapeutik untuk Pergigian (Edisi Ketujuh). Pulih dari Scientedirect.com.
- Coppock, r.W. dan Dziwenka, m. (2015). Ancaman terhadap hidupan liar oleh ejen peperangan kimia. Dalam Buku Panduan Toksikologi Ejen Peperangan Kimia (edisi kedua). Pulih dari Scientedirect.com.
- Morrison, r.T. dan Boyd, r.N. (2002). Kimia organik. Edisi ke -6. Prentice-Hall.
- « Struktur, So3) Struktur, Harta, Risiko, Kegunaan Sulfur (SO3)
- Struktur, sifat, penggunaan, risiko barium oksida (BAO) »

