Struktur, sifat, penggunaan, risiko barium oksida (BAO)

- 4266
- 686
- Ms. Micheal Rippin
Dia barium oksida Ia adalah pepejal bukan organik yang dibentuk oleh atom barium (BA) dan atom oksigen (O). Formula kimianya adalah bao. Ia adalah pepejal kristal putih dan hygroscopic, iaitu, ia menyerap kelembapan udara, tetapi dengan berbuat demikian ia bertindak balas dengan ini.
Reaksi pesat barium oksida dengan air menjadikannya digunakan dalam makmal analisis kimia, iaitu, menghapuskan air dari pelarut organik, yang merupakan sebatian cecair yang berfungsi untuk membubarkan bahan lain.
 Bao barium oksida pepejal. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Bao barium oksida pepejal. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Bao berkelakuan seperti asas yang kuat, oleh itu bertindak balas dengan pelbagai jenis asid. Contohnya bertindak balas dengan mudah dengan karbon dioksida2 udara untuk membentuk barium karbonat bacchus3.
Ia berfungsi dalam pembuatan polimer untuk kabel elektrik dan sebagai bahan resin untuk menutup lubang gigi yang telah sembuh.
Barium Oxide (BAO) juga digunakan dalam industri seramik, baik untuk menutupnya dengan kaca dan untuk mengeluarkannya. Ia juga digunakan dalam campuran simen untuk meningkatkan rintangan mampatan produk akhir.
[TOC]
Struktur
Bao Baar Oxide dibentuk oleh kation BA2+ dan anion oksigen atau2-.
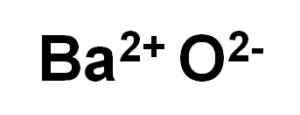 Ion bao barium oksida. Pengarang: Marilú Stea.
Ion bao barium oksida. Pengarang: Marilú Stea. Dalam kristalnya, Bao membentuk rangkaian ionik padu (dalam bentuk kiub) jenis natrium klorida.
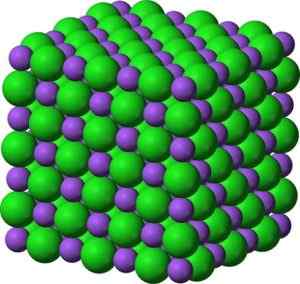 Bao barium oksida -struktur kristal yang sama seperti natrium klorida. Hijau: Barium. Biru: Oksigen. Benjah-bmm27 (bercakap · contribs) [domain awam]. Sumber: Wikimedia Commons.
Bao barium oksida -struktur kristal yang sama seperti natrium klorida. Hijau: Barium. Biru: Oksigen. Benjah-bmm27 (bercakap · contribs) [domain awam]. Sumber: Wikimedia Commons. Konfigurasi elektronik ion barium adalah: [xe] 6s0 Nah, kedua -dua elektron lapisan 6s telah hilang. Konfigurasi ini sangat stabil.
Nomenclature
-Barium oksida
-Barium monoksida
Ia boleh melayani anda: ujian: ciri, jenis, contoh kegunaanCiri-ciri fizikal
Keadaan fizikal
Pepejal kristal putih kekuningan.
Berat molekul
153.33 g/mol
Takat lebur
1923 ºC
Takat didih
Kira -kira 2000 ºC.
Ketumpatan
5.72 g/cm3
Kelarutan
Larutan Air Little: 3.8 g/100 ml pada 20 ºC.
Sifat kimia
Bario Bao Oxide bertindak balas dengan cepat2, yang merupakan hidroksida yang paling larut antara hidroksida logam alkalineterik.
Bao + h2O → ba (oh)2
Bao adalah pangkalan yang kuat. Bertindak balas secara eksotermik (iaitu, dengan detasmen haba) dengan semua jenis asid.
Dengan co2 Bao bertindak balas untuk membentuk barium karbonat bacchus3.
Bao + co2 → Bacchus3
Bao adalah hygroscopic, kerana jika ia dibenarkan untuk alam sekitar, ia secara beransur -ansur bergabung dengan kelembapan udara, membentuk BA (OH)2 yang digabungkan dengan karbon dioksida2 udara untuk memberi barium karbonat bacchus3.
Apabila bao barium monoksida dipanaskan dengan kehadiran udara, ia digabungkan dengan oksigen yang membentuk barium peroksida bao2. Tindak balasnya boleh diterbalikkan.
2 bao + o2 ⇔ 2 bao2
Di hadapan air, ia boleh bertindak balas dengan aluminium kepada atau dengan Fifc Zn yang membentuk oksida atau hidroksida logam ini dan menghasilkan gas hidrogen h2.
Anda boleh memulakan pempolimeran sebatian organik yang boleh dipolimerisasi, seperti epoksida.
Risiko
Ia boleh menjadi toksik dengan pengambilan. Anda tidak boleh menghubungi kulit. Ia adalah mata yang menjengkelkan, kulit dan saluran pernafasan. Ia boleh membahayakan sistem saraf. Ia dapat menyebabkan tahap kalium yang rendah, mengakibatkan gangguan jantung dan otot.
Memperoleh
Bao Barium Oxide boleh didapati dengan memanaskan Bario Baco Carbonate3 Dengan arang batu. Bao terbentuk dan gas karbon monoksida dibebaskan.
Bacchus3 + C → bao + 2 co ↑
Aplikasi
Sebagai pelarut organik
Kerana kemudahannya untuk bertindak balas dengan air, Bao telah digunakan sejak pertengahan abad yang lalu sebagai pengertian untuk petrol dan pelarut organik asas.
Ia boleh melayani anda: asid cyanhydric: struktur molekul, sifat, kegunaanBao sangat aktif pengeringan di sekelilingnya, ia memerlukan kelembapan dengan cepat, dengan evolusi cukup panas, membentuk barium hidroksida BA (OH)2 yang stabil sehingga kira -kira 1000 ºC. Oleh itu BAO boleh digunakan pada suhu tinggi.
Ia juga mempunyai kapasiti penyerapan air yang tinggi. Untuk setiap molekul bao seseorang dapat menyerap air dan BA (oh)2 Hasil juga boleh menyerap sejumlah air.
Ia sesuai untuk makmal kimia analisis. Ia tidak melekit.
Ia boleh digunakan di desiccators, yang merupakan bekas kaca besar dengan tudung di mana suasana dalaman kering dikekalkan. Bao menyimpan miniatmosfera desiccator kering.
 Distinters di makmal. Pepejal pengering seperti Bao diletakkan di bahagian bawah pangkalan. Pemuat naik asal ialah Rifleman 82 di Wikipedia Bahasa Inggeris. [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Distinters di makmal. Pepejal pengering seperti Bao diletakkan di bahagian bawah pangkalan. Pemuat naik asal ialah Rifleman 82 di Wikipedia Bahasa Inggeris. [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons. Desiccators ini berfungsi untuk meletakkan bahan atau reagen dan dengan itu menghalang mereka daripada menyerap air dari alam sekitar.
Ia juga berfungsi untuk mengeringkan gas asas seperti ammonia NH3.
Dalam lampu muat turun
Bao diletakkan di dalam elektrod lampu pelepasan sebagai bahan pemancar elektron.
Lampu pelepasan dibentuk oleh tiub kaca, kuarza atau bahan lain yang sesuai, mengandungi gas lengai dan dalam kebanyakan kes wap logam. Wap logam boleh menjadi natrium atau merkuri.
 Lampu merkuri. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Lampu merkuri. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Di dalam tiub, kejutan elektrik berlaku kerana ia mempunyai elektrod positif dan negatif.
Bao diletakkan di dalam elektrod lampu. Elektron dipancarkan bertembung dengan atom stim logam dan menghantar tenaga.
Ia boleh melayani anda: Cupric Oxide (CUO)Semasa melepasi arus elektrik melalui gas atau stim ini terdapat cahaya yang kelihatan atau radiasi ultraviolet (UV).
Dalam pembuatan seramik
Bao digunakan dalam komposisi salutan seramik.
 Fasad bangunan bersalut dengan seramik berkilat. Penny Mayes/Glazed Façade. Sumber: Wikimedia Commons.
Fasad bangunan bersalut dengan seramik berkilat. Penny Mayes/Glazed Façade. Sumber: Wikimedia Commons. Walau bagaimanapun, ia juga telah diuji sebagai bahan tambahan dalam penyediaan hob.
BAO berkesan meningkatkan ciri -ciri mekanikal dan rintangan kimia jenis seramik ini. Ia mempunyai pengaruh yang kuat terhadap sifat terma dan komposisi fasa kristal bahan yang diperolehi.
Dalam penyediaan campuran simen
BAO telah diuji sebagai komponen simen phosphoaluminate.
Jenis simen ini berguna dalam persekitaran laut, kerana ia tidak mempunyai kecenderungan yang sama untuk menghidrat sebagai jenis simen yang lain, jadi ia tidak mengalami liang atau pengembangan.
Walau bagaimanapun, simen phosphoalumination perlu diperkuatkan dalam prestasi mekanikal mereka untuk dapat menahan arus laut dan pukulan kepingan ais yang ada di lautan.
Penambahan BAO ke simen fosfoalasi mengubah struktur mineral bahan tersebut, meningkatkan struktur liang -liang dan meningkatkan daya mampatan tampalan simen.
Dengan kata lain, BAO meningkatkan rintangan mampatan jenis simen ini.
 Campurkan untuk konkrit. Bao Barium Oxide berguna untuk memperbaiki sifat simen tertentu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Campurkan untuk konkrit. Bao Barium Oxide berguna untuk memperbaiki sifat simen tertentu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Dalam beberapa aplikasi
Ia digunakan sebagai ramuan untuk memberikan kelegapan dalam resin gigi untuk mengisi lubang di gigi, yang dilakukan oleh doktor gigi.
Ia juga digunakan sebagai ejen nukleasi untuk penyediaan polimer fluorida polyvinylidene yang digunakan untuk mengasingkan kabel elektrik.
Rujukan
- Partyka, J. et al. (2016). Kesan penambahan Bao pada sintering bahan-bahan seramik dari Sio2-Kepada2Sama ada3-Na2BAIK2Sistem O-CAO/MGO. J Therm Anal Calim (2016) 125: 1095. Pautan pulih.Springer.com.
- Zhang, ms. et al. (2019). Kesan BAO terhadap struktur mineral dan tingkah laku penghidratan simen fosfoaluminate. J Therm Anal Calim (2019) 136: 2319. Pautan pulih.Springer.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Barium oksida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Smith, n.Ke. (2003). Pencahayaan. Prinsip. Dalam buku rujukan jurutera elektrik (edisi keenam belas). Pulih dari Scientedirect.com.
- Ebnejjad, s. (2003). Fluoropolymer Foams. PVDF berbuih. Dalam cair fluoroplastik yang boleh diproses. Pulih dari Scientedirect.com.
- Booth, h.S. dan McIntyre, l.H. (1930). Barium oksida sebagai pengerusi. Ind. Eng. Chem. Dubur. Ed. 1930, 2, 1, 12-15. Pulih dari pub.ACS.org.
- « Struktur, sifat natrium sianida (NACN), Risiko, Kegunaan
- 15 makanan terbaik untuk meningkatkan punggung (semula jadi) »

