Sulfur oksida
- 1894
- 365
- Ms. Micheal Rippin
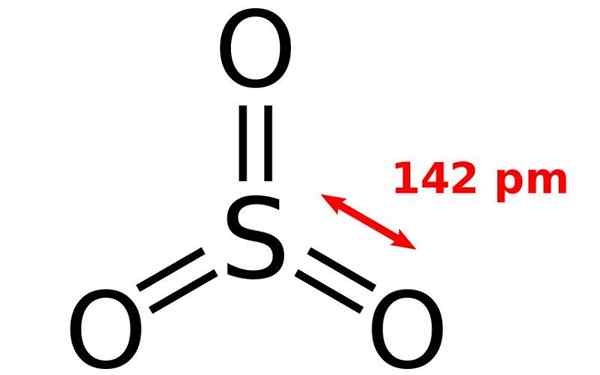
 Struktur kimia molekul sulfur oksida. Sumber: Joel Holdsworth, Wikimedia Commons
Struktur kimia molekul sulfur oksida. Sumber: Joel Holdsworth, Wikimedia Commons Apa itu Sulfur Oxide?
Dia Sulfur oksida (Vi), juga dikenali sebagai sulfur atau sulfurik anhidrida trioksida, adalah sebatian kimia formula s3, Itu, dalam keadaan normal, ia adalah pepejal yang tidak berwarna dan berserabut, dan pada 25 ° C dan 1 atm adalah ejen pencemar yang kuat, yang bertanggungjawab untuk hujan asid.
Sulfur trioksida dihasilkan oleh pengoksidaan oksida sulfur.
Sehingga kini, satu -satunya penyediaan trioksida sulfur murni dari gas yang mengandungi3 dicairkan, ia telah menjadi proses di skala tumbuhan perintis yang membayangkan pemeluwapan kritikal.
Prosedur biasa menyiratkan, sebaliknya, penyulingan minyak. Haba yang diperlukan untuk penyulingan minyak dibekalkan dengan lebih mudah oleh gas hubungan panas dari loji asid sulfurik yang berkaitan.
Ia boleh disediakan di makmal dengan pemanasan asid sulfurik merokok dan mengumpul sublimasi dalam penerima yang disejukkan. Sekiranya stim dipendekkan melebihi 27 ° C, bentuk gamma diperolehi sebagai cecair.
Sekiranya stim dipendekkan di bawah 27 ° C dan dengan kehadiran garis kelembapan, campuran tiga bentuk diperolehi. Bentuk 3 boleh dipisahkan oleh penyulingan pecahan.
Pembakaran bahan api fosil adalah punca penampilannya di atmosfera, ini menjadi penyebab utama antropogenik.
Sifat fizikal dan kimia sulfur oksida
- Sulfur Trioksida berbentuk seperti jarum putih yang menjadi asap di udara. Anda sering menemui inhibitor untuk mengelakkan pempolimeran.
Boleh melayani anda: Renio: penemuan, sifat, struktur, kegunaan- Berat molekulnya adalah 80,066 g/mol, ketumpatannya adalah 1.92 g/cm³ g/ml dan titik gabungan dan mendidih masing -masing adalah 16.8 ° C dan 44.7 ° C,.
- Kompaun digabungkan dengan air dengan daya letupan, membentuk asid sulfurik kerana keasidannya. Bahan organik trioksida karboniza sulfur.
- Sulfur trioksida menyerap kelembapan dengan cepat, memancarkan asap putih padat. Penyelesaian trioksida asid sulfurik dipanggil asid sulfurik merokok atau minyak.
- Reaksi trioksida sulfur dan diffluoride oksigen sangat kuat dan letupan dihasilkan jika reaksi dilakukan tanpa adanya pelarut.
- Reaksi trioksida sulfur yang berlebihan dengan tetrafluoroethylene menyebabkan penguraian bahan letupan fluorida karbonil dan sulfur dioksida.
- Reaksi asid perchloric anhydrous dengan sulfur trioksida adalah ganas dan disertai dengan evolusi haba yang besar. Trioksida sulfur cecair bertindak balas dengan ganas dengan nitril klorida, malah 75 ° C.
- Reaksi trioksida sulfur dan oksida plumbum menyebabkan luminescence putih. Gabungan yodin, piridin, sulfur dan formamide trioksida mengembangkan gas pada tekanan selepas beberapa bulan.
Ini disebabkan oleh pembentukan asid sulfurik yang perlahan, air luaran atau dehidrasi formamida sianida hidrogen.
Risiko
Sulfur Trioksida adalah sebatian yang stabil, tidak serasi dengan bahan organik, logam serbuk halus, pangkalan, air, sianida dan pelbagai bahan kimia lain.
Bahan ini adalah oksidan yang kuat dan bertindak balas dengan ganas dengan bahan dan penganjur yang mudah terbakar dan sebatian organik yang menyebabkan kebakaran dan bahaya letupan.
Boleh melayani anda: Natrium oksalat (Na2C2O4): Struktur, sifat, kegunaan, risikoBertindak balas dengan ganas dengan air basah dan udara untuk menghasilkan asid sulfurik. Penyelesaian di dalam air adalah asid yang kuat, ia bertindak balas dengan ganas dengan pangkalan dan logam menghakis, membentuk gas mudah terbakar / letupan.
Kompaunnya menghakis untuk logam dan tisu. Menyebabkan luka bakar di mata dan kulit. Pengambilan menyebabkan luka bakar teruk di mulut, esofagus dan perut. Stim sangat toksik dengan penyedutan.
Sekiranya hubungan mata, anda mesti mengesahkan sama ada kanta lekap digunakan dan mengeluarkannya dengan segera. Mata harus dibilas dengan air mengalir selama sekurang -kurangnya 15 minit, menjaga kelopak mata terbuka. Air sejuk boleh digunakan, tanpa menggunakan salap mata.
Sekiranya bahan kimia bersentuhan dengan pakaian, simpannya secepat mungkin, melindungi tangan dan badannya sendiri. Letakkan mangsa di bawah mandi keselamatan.
Sekiranya bahan kimia berkumpul di kulit yang terdedah kepada mangsa, seperti tangan, kulit yang tercemar dengan air yang mengalir dan sabun yang tidak abrasive dibasuh dengan lembut dan berhati -hati. Air sejuk boleh digunakan. Sekiranya kerengsaan berterusan, dapatkan perhatian perubatan. Basuh pakaian yang tercemar sebelum menggunakannya lagi.
Sekiranya penyedutan, mangsa harus dibenarkan berdiri di kawasan pengudaraan yang baik. Sekiranya penyedutan itu serius, mangsa mesti dipindahkan ke kawasan yang selamat secepat mungkin. Pakaian ketat longgar, seperti leher baju, tali pinggang atau tali leher.
Sekiranya mangsa sukar bernafas, oksigen mesti diberikan. Sekiranya mangsa tidak bernafas, resusitasi mulut dibuat. Sentiasa mengambil kira bahawa ia boleh berbahaya bagi orang yang memberikan bantuan untuk memberi mulut ke mulut ke mulut apabila bahan yang disedut adalah toksik, berjangkit atau mengakis.
Ia boleh melayani anda: asid pituitari (H3PO2): sifat, kegunaan dan reagenDalam semua kes, perhatian perubatan segera harus dicari.
Sebaliknya, pencemaran udara akibat oksida sulfur adalah masalah alam sekitar yang penting, dengan berjuta -juta tan sulfur dioksida dan trioksida yang dipancarkan ke atmosfera setiap tahun. Sebatian ini berbahaya kepada tumbuhan dan kehidupan haiwan, serta untuk banyak bahan binaan.
Satu lagi masalah besar yang perlu dipertimbangkan ialah hujan asid. Kedua -dua oksida sulfur dibubarkan dalam titisan air atmosfera untuk membentuk penyelesaian asid, yang boleh menjadi sangat berbahaya apabila mereka jatuh dalam bentuk hujan.
Hujan asid boleh merosakkan hutan dan menyebabkan ikan mati di banyak tasik. Ia juga menghakis untuk logam, batu kapur dan bahan lain. Penyelesaian yang mungkin untuk masalah ini mahal kerana kesukaran menghapuskan sulfur arang batu dan minyak sebelum mereka membakar.
Aplikasi
- Sulfur trioksida adalah reagen penting dalam tindak balas sulfonasi. Proses ini menyediakan detergen, pewarna dan produk farmaseutikal. Ia dihasilkan di situ dari asid sulfurik atau digunakan sebagai larutan asid sulfurik merokok.
- Ciri -ciri disinfektannya bertanggungjawab selama berabad -abad untuk digunakan untuk membasmi kiub wain, membakar belerang di dalamnya.
Rujukan
- Sulfur trioksida. Pulih dari EBI.Ac.UK
- Lembaran data keselamatan sulfur trioksida. Pulih dari Sciencelab.com

