Boron Oxide (B2O3) Apakah, Struktur, Hartanah, Kegunaan
- 724
- 142
- Mr. Tracy Parisian
Dia Boron Oxide O Boric Anhydride adalah sebatian bukan organik yang formula kimianya b2Sama ada3. Menjadi elemen boron dan oksigen blok P jadual berkala, dan lebih banyak lagi kepala kumpulan masing -masing, perbezaan elektronegativiti di antara mereka tidak terlalu tinggi; Oleh itu, diharapkan B2Sama ada3 menjadi sifat kovalen.
B2Sama ada3 Ia disediakan dengan membubarkan boraks dalam asid sulfurik pekat di dalam ketuhar penggabungan dan pada suhu 750ºC; Asid borik dehidrasi termal, B (OH)3, pada suhu kira -kira 300 ° C; atau ia juga boleh dibentuk sebagai produk reaksi diborano (b2H6) Dengan oksigen.
Boro oksida boleh mempunyai penampilan kaca separuh -transparan, atau kristal; Yang terakhir dengan pengisaran dapat diperolehi dalam bentuk habuk.
Walaupun nampaknya tidak kelihatan pertama, B dianggap2Sama ada3 sebagai salah satu oksida anorganik yang paling kompleks; Bukan sahaja dari sudut pandangan struktur, tetapi juga disebabkan oleh sifat -sifat pembolehubah yang diperolehi oleh kaca dan seramik yang ditambah ke matriks mereka.
Struktur Boro Oxide
Perpaduan BO3
B2Sama ada3 Ia adalah kovalen, jadi dalam teori mereka tidak wujud dalam struktur ion b3+ Nor2-, Tetapi pautan B-O. Boron, menurut Teori Pautan Valencia (TEV), hanya boleh membentuk tiga pautan kovalen; Dalam kes ini, tiga pautan B-O. Akibatnya, geometri yang dijangkakan mestilah trigonal, bo3.
Molekul BO3 Ia adalah elektron miskin, terutamanya atom oksigen; Walau bagaimanapun, beberapa daripada mereka boleh berinteraksi antara satu sama lain untuk membekalkan kekurangan tersebut. Oleh itu, segitiga bo3 Mereka disertai dengan berkongsi jambatan oksigen, dan diedarkan di ruang angkasa sebagai rangkaian segi tiga dengan pesawat mereka berorientasikan dengan cara yang berbeza.
Boleh melayani anda: penyelesaian tak tepuStruktur kristal
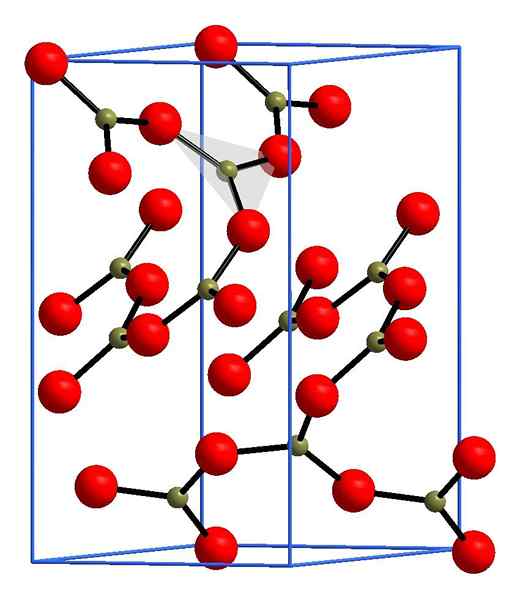
 Struktur Boro Oxide. Andif1, Wikimedia Commons.
Struktur Boro Oxide. Andif1, Wikimedia Commons. Dalam imej atas contoh baris ini dengan unit segi tiga bo3. Sekiranya ia diperhatikan dengan teliti, tidak semua wajah rancangan menunjukkan kepada pembaca, tetapi ke sisi lain. Orientasi wajah ini boleh bertanggungjawab untuk bagaimana b ditakrifkan2Sama ada3 pada suhu dan tekanan tertentu.
Apabila rangkaian ini mempunyai corak struktur yang panjang, ia adalah pepejal kristal, yang boleh dibina dari sel unitnya. Di sinilah dikatakan bahawa b2Sama ada3 Ia mempunyai dua polimorf kristal: α dan β.
Α-B2Sama ada3 Ia dihasilkan dalam tekanan ambien (1 atm), dan dikatakan bahawa ia tidak stabil; Malah, ini adalah salah satu sebab mengapa boron oksida mungkin merupakan kompaun penghabluran yang sukar.
Polimorf lain, β-b2Sama ada3, Tekanan tinggi diperolehi dalam julat GPA; Oleh itu, ketumpatannya mestilah lebih besar daripada α-b2Sama ada3.
Struktur vitreous
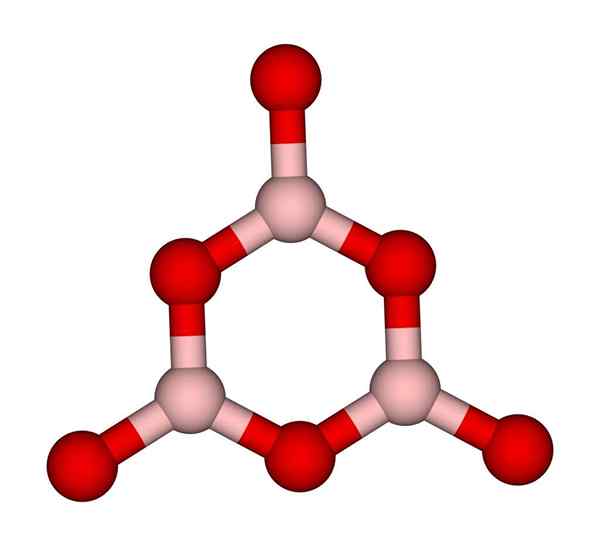 Cincin boroxol. Ccoil (bercakap). Wikimedia Commons.
Cincin boroxol. Ccoil (bercakap). Wikimedia Commons. Rangkaian Bo3 Secara semulajadi cenderung mengamalkan struktur amorf; Ini adalah, kekurangan corak yang menggambarkan molekul atau ion dalam pepejal. Dengan mensintesis b2Sama ada3 Bentuk dominannya adalah amorf dan bukan kristal; Dengan kata -kata yang betul: ia lebih padat lebih vitreous daripada kristal.
Kemudian dikatakan bahawa b2Sama ada3 Ia adalah vitreous atau amorfus ketika anak lelaki bo anda3 Mereka tidak kemas. Bukan sahaja ini, tetapi juga mengubah cara mereka bergabung. Daripada memesan dalam geometri trigonal, cincin boroxol (imej unggul) berakhir untuk membuat penyelidik (imej unggul).
Boleh melayani anda: 20 contoh tenaga kimiaPerhatikan perbezaan yang jelas antara unit segi tiga dan heksagon. Segitiga mencirikan b2Sama ada3 kristal, dan heksagon ke b2Sama ada3 vitreous. Satu lagi cara untuk merujuk fasa amorf ini adalah kaca boron, atau dengan formula: g-b2Sama ada3 ('G' berasal dari perkataan kaca, dalam bahasa Inggeris).
Oleh itu, rangkaian G-b2Sama ada3 Mereka terdiri daripada cincin boroxol dan bukan unit bo3. Walau bagaimanapun, G-B2Sama ada3 boleh mengkristal ke α-b2Sama ada3, yang akan menyiratkan interversi cincin ke segitiga, dan juga menentukan tahap penghabluran yang dicapai.
Sifat
Penampilan fizikal
Ia adalah pepejal yang tidak berwarna dan kaca. Dalam bentuk kristalnya berwarna putih.
Jisim molekul
69,6182 g/mol.
Rasa
Sedikit pahit
Ketumpatan
-Crystalline: 2.46 g/ml.
-Vitreous: 1.80g/ml.
Takat lebur
Ia tidak mempunyai titik gabungan yang jelas, kerana ia bergantung pada bagaimana kristal atau vitreous. Bentuk kristal semata -mata mencairkan hingga 450ºC; Walau bagaimanapun, bentuk vitreous cair ke dalam julat suhu yang meliputi dari 300 hingga 700ºC.
Takat didih
Sekali lagi, nilai yang dilaporkan tidak sepadan dengan nilai ini. Nampaknya boron oksida cecair (cair dari kristal atau gelasnya) mendidih pada 1860ºC.
Kestabilan
Ia mesti disimpan kering, kerana ia menyerap kelembapan untuk berubah menjadi asid borik, b (oh)3.
Nomenclature
Boro Oxide boleh dinamakan dengan cara lain, seperti:
-Diboro Trioxide (Tatanama Sistematik).
-Boron Oxide (III) (Tatanama Saham).
-Oxide Boric (Tatanama Tradisional).
Aplikasi
Beberapa kegunaan boron oksida adalah:
Sintesis Boro Trihalogenuros
Dari b2Sama ada3 Boleh disintesis oleh Trihalogenuros de Boro, BX3 (X = f, cl y br). Sebatian ini adalah asid Lewis, dan dengan mereka adalah mungkin untuk memperkenalkan atom boron kepada molekul tertentu untuk mendapatkan derivatif lain dengan sifat baru.
Ia boleh melayani anda: ion polyiatomik: senarai dan latihanInsektisida
Campuran pepejal dengan asid borik, b2Sama ada3-B (oh)3, mewakili formula yang digunakan sebagai insektisida domestik.
Pelarut oksida logam: pembentukan kaca, seramik dan aloi boron
Boron oksida cecair mampu membubarkan oksida logam. Dari campuran yang dihasilkan ini, sekali disejukkan, pepejal yang terdiri daripada boron dan logam diperoleh.
Bergantung pada jumlah b2Sama ada3 Digunakan, serta teknik, dan jenis oksida logam, pelbagai jenis kaca (borosilicates), seramik (nitrida dan karbida boron), dan aloi boleh diperolehi (jika hanya logam digunakan).
Secara umum, kaca atau seramik memperoleh rintangan dan kekuatan yang lebih besar, dan juga ketahanan yang lebih besar. Dalam kes kaca, mereka akhirnya digunakan untuk kanta optik dan teleskop, dan untuk peranti elektronik.
Pengikat
Dalam pembinaan ketuhar keluli, batu bata refraktori dengan magnesium digunakan. Di dalamnya, boron oksida digunakan sebagai pengikat, membantu memastikan mereka bersatu dengan kuat.
Rujukan
- Boric Oxide. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- BORIX OXIDE. 20 Mule Team Borax. Pulih dari: borax.com

