Potassium Oxide (K2O)
- 3784
- 15
- Ms. Edgar Carroll
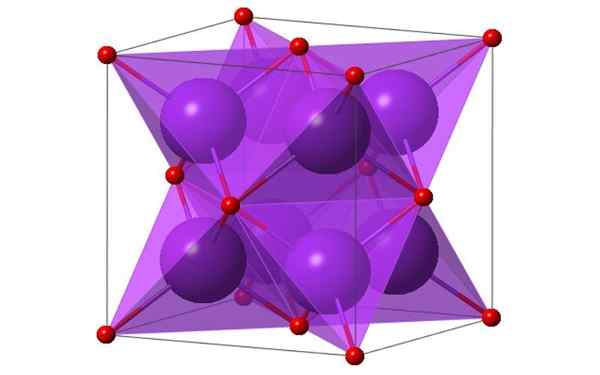
 Reka bentuk padu 4 molekul kalium oksida. Sumber: KTLabe, Wikimedia Commons
Reka bentuk padu 4 molekul kalium oksida. Sumber: KTLabe, Wikimedia Commons Apa itu Potassium Oxide?
Dia Potassium Oxide, Juga dipanggil dipotasium oksida, ia adalah garam oksigen dan kalium ionik, dengan formula k2Sama ada. Ia adalah kalium oksida yang paling mudah, sangat reaktif dan jarang dijumpai. Beberapa bahan perdagangan, seperti baja dan simen2Sama ada.
Potassium oksida dihasilkan dari kalium hidroksida (potassa kaustik) dan kalium logam 450 ° C, menghasilkan hidrogen molekul mengikut persamaan:
2K + 2KOH ⇌ 2K2Atau + h2 (450 ° C).
Ia juga diperoleh dengan mengurangkan kalium peroksida mengikut reaksi:
2k2Sama ada2 → k2Atau + o2 (530 ° C).
Kaedah lain untuk mendapatkan kalium oksida adalah dengan memanaskan kalium karbonat pada suhu tinggi, seperti yang ditunjukkan oleh reaksi berikut:
K2Co3 ⇌ k2O + Co₂ (t> 1200 ° C).
Walau bagaimanapun, cara utama mendapatkan kalium oksida adalah dengan pemanasan kalium nitrat, mendapatkan nitrogen molekul seperti yang ditunjukkan oleh reaksi berikut:
2kno3 + 10k → 6k2Atau + n2
Sifat fizikal dan kimia
- Mereka adalah kristal tetrahedral, kekuningan, tanpa aroma ciri.
- Ia mempunyai berat molekul 94.2 g/mol dan ketumpatan 2.13 g/ml pada 24 ° C.
- Ia mempunyai titik lebur 740 ° C, walaupun ia mula terurai pada suhu 300 ° C.
- Ia tahan panas dan larut dalam etanol dan eter. K2Atau mengkristalisasi dalam struktur antifluorit. Atas sebab ini, kedudukan anion dan kation dilaburkan berhubung dengan kedudukan mereka di CAF2, dengan ion kalium yang diselaraskan hingga 4 ion ion oksida dan oksida yang diselaraskan pada 8 kalium.
- Ia adalah oksida asas dan bertindak balas dengan air dengan ganas untuk menghasilkan kalium hidroksida kaustik. Ia adalah lazat dan menyerap air dari atmosfera, memulakan reaksi yang kuat ini.
Ia boleh melayani anda: kalsium nitrat (CA (NO3) 2)- Ia mengoksidakan secara terbalik ke kalium peroksida pada suhu 350 ° C, bertindak balas dengan ganas dengan asid, seperti asid hidroklorik, untuk membentuk garam kalium mengikut reaksi:
K2O + 2hcl → 2kcl + h₂o.
- Bertindak balas dengan nitrogen dioksida untuk membentuk nitrat dan kalium nitrit pada suhu antara 150 dan 200 ° C:
K2O + 2NO2 = Kno2 + Kno3
- Bertindak balas pada suhu rendah dengan ammonia untuk membentuk amidas dan kalium hidroksida mengikut reaksi:
K2O + NH3 (L) → KNH2↓ + KOH (-50 ° C).
Risiko
Potassium Oxide adalah bahan yang tidak stabil. Mudah mengoksidakan potassium, peroksida atau asid kalium (kho) oksida (KHO). Kompaun tidak bahan api, tetapi ia bertindak balas dengan kuat dan eksothermically dengan air untuk membentuk kalium hidroksida (KOH).
Penyelesaian potassium oksida di dalam air adalah asas yang kuat, bertindak balas dengan ganas dengan asid dan menghakis. Bertindak balas dengan ganas dengan air yang menghasilkan kalium hidroksida. Menyerang banyak logam di hadapan air.
Bahan itu menghakis untuk mata, kulit dan saluran udara, serta dengan meminum. Penyedutan aerosol boleh menyebabkan edema pulmonari, gejala yang sering ditunjukkan selepas beberapa jam, dan diperburuk oleh usaha fizikal.
Sekiranya hubungan mata, anda mesti mengesahkan sama ada kanta lekap digunakan dan mengeluarkannya dengan segera. Mata harus dibasuh dengan air mengalir selama sekurang -kurangnya 15 minit, dengan kelopak mata terbuka. Air sejuk boleh digunakan, dan bukan salap mata.
Sekiranya bahan kimia bersentuhan dengan pakaian, simpannya secepat mungkin, melindungi tangan dan badannya sendiri. Letakkan mangsa di bawah mandi keselamatan.
Sekiranya bahan kimia berkumpul di kulit yang terdedah, seperti tangan, kulit yang tercemar dengan air yang mengalir dan sabun yang tidak abrasive dibasuh dengan lembut dan berhati -hati. Air sejuk boleh digunakan. Sekiranya kerengsaan berterusan, dapatkan perhatian perubatan. Basuh pakaian yang tercemar sebelum menggunakannya lagi.
Ia boleh melayani anda: Rubidio: Sejarah, Hartanah, Struktur, Mendapatkan, MenggunakanSekiranya sentuhan kulit serius, ia harus dibasuh dengan sabun disinfektan dan menutup kulit yang tercemar dengan krim antibakteria.
Sekiranya penyedutan, mangsa harus dibenarkan berdiri di kawasan pengudaraan yang baik. Sekiranya penyedutan itu serius, mangsa mesti dipindahkan ke kawasan yang selamat secepat mungkin.
Keluarkan pakaian yang ketat, seperti leher baju, tali pinggang atau tali leher. Sekiranya mangsa sukar bernafas, oksigen mesti diberikan. Sekiranya mangsa tidak bernafas, resusitasi mulut dibuat.
Sentiasa mengambil kira bahawa ia boleh berbahaya bagi orang yang memberikan bantuan untuk memberi mulut ke mulut ke mulut apabila bahan yang disedut adalah toksik, berjangkit atau mengakis.
Sekiranya berlaku pengambilan, ia tidak mendorong muntah. Melonggarkan pakaian yang ketat. Dalam semua kes, perhatian perubatan segera harus dicari.
Aplikasi
- Formula kimia k2Atau (atau hanya k) digunakan dalam beberapa konteks perindustrian: nombor n-p-k untuk baja, formula simen dan formula kaca.
Ia sering tidak digunakan secara langsung dalam produk ini, tetapi jumlah kalium dilaporkan dari segi persamaan K2Atau untuk sebarang jenis sebatian kalium yang digunakan, seperti kalium karbonat.
- Potassium Oxide adalah kira -kira 83% daripada kalium kalium, manakala kalium klorida hanya 52%. Potassium Chloride memberikan kurang kalium daripada jumlah kalium oksida yang sama.
Oleh itu, jika baja adalah 30% kalium klorida berat, indeks kalium standardnya, berdasarkan kalium oksida, hanya 18.8%. Ia dihasilkan dan/atau antara 10 dan 100 tan setahun bahan ini di ruang ekonomi Eropah.
Boleh melayani anda: Kimia dalam Kehidupan Seharian: +30 Contoh- Bahan ini digunakan dalam bahan kimia makmal, baja, polimer dan produk fitosanitasi. K2O Ia mempunyai penggunaan perindustrian yang menghasilkan pembuatan bahan lain (penggunaan produk perantaraan).
- Potassium Oxide digunakan di kawasan campuran dan/atau pertanian, perhutanan dan perumahan. Ia digunakan untuk pembuatan bahan kimia, produk plastik dan produk mineral (contohnya, plaster, simen).
- Ia digunakan di luar rumah dalam bahan panjang dengan pelepasan kelajuan rendah, contohnya, bahan logam, kayu dan plastik.
- Bahan dalaman, panjang digunakan dengan kelajuan rendah, seperti perabot, mainan, bahan binaan, langsir, kasut, produk kulit, kertas dan produk kadbod, peralatan elektronik.
- Bahan ini boleh didapati dalam produk dengan bahan berasaskan batu, plaster, simen, kaca atau seramik (contohnya, plat, periuk / kuali, bekas penyimpanan makanan, bahan pembinaan dan penebat).
- Potassium Oxide adalah sumber termal yang stabil, sangat tidak larut, sesuai untuk aplikasi kaca, optik dan seramik. Sebatian oksida tidak menjalankan elektrik.
- Ia juga digunakan dalam komponen struktur ringan dalam aplikasi aeroangkasa dan elektrokimia seperti bateri bahan api di mana kekonduksian ionik mempamerkan.
Rujukan
- Elemen Amerika (s.F.). Potassium Oxide. Pulih dari Amerika.com.
- Dipassium oxide. Pulih dari Echa.Eropah.EU.

