Oksida asas

- 4194
- 218
- Ms. Micheal Rippin
Kami menerangkan apa oksida asas, bagaimana sifat mereka, tatanama dan memberikan beberapa contoh terbentuk,
 Banyak oksida asas mempunyai ciri -ciri warna logam
Banyak oksida asas mempunyai ciri -ciri warna logam Apakah oksida asas?
The oksida asas Mereka adalah sebatian bukan organik yang dibentuk oleh kesatuan antara oksigen dan logam. Mereka dipanggil oksida asas kerana mereka menghasilkan penyelesaian alkali atau asas apabila melarutkan air. Juga kerana mereka bertindak balas dengan asid untuk membentuk garam dan air melalui tindak balas peneutralan asid.
Oksida asas sangat biasa. Malah, kebanyakan logam di alam boleh didapati di tanah oksida, jadi mereka dulu dipanggil tanah.
Oksida asas sangat penting bagi industri. Banyak pigmen berwarna yang digunakan dalam industri adalah oksida. Oksida lain digunakan sebagai asas untuk lukisan, terutama titanium, plumbum dan zink oksida.
Sifat oksida asas
Mereka adalah sebatian binari
Sebatian ini hanya dibentuk oleh dua elemen: oksigen dan logam. Oleh itu, mereka adalah sebatian binari.
Formula empirikalnya adalah m2Sama adaX atau moX/2
Valensi oksigen dalam oksida selalu -2, jadi formula empirikal oksida dipermudahkan apabila valencia logam adalah nombor tork. Walau bagaimanapun, perkara yang sama tidak berlaku apabila ia ganjil.
Contohnya, formula empirikal natrium oksida adalah na2Atau kerana natrium mempunyai Valencia +1 (ganjil). Sebaliknya, formula empirikal kalsium oksida adalah CaO, kerana kalsium mempunyai Valencia +2.
Mereka adalah sebatian bukan organik, hampir selalu ionik
Kebanyakan oksida asas adalah sebatian ionik kristal. Ini termasuk oksida semua logam alkali, semua alkaliner (kecuali untuk berilium) dan siri pertama logam peralihan.
Boleh melayani anda: ikatan kimiaMereka mempunyai gabungan yang sangat tinggi dan mata mendidih
Ikatan ionik menyimpan semua ion yang membentuk oksida asas yang sangat bersatu. Ini menjadikan mereka sukar untuk mencairkan dan lebih sukar untuk menguap. Atas sebab ini, mereka mempunyai titik gabungan dan mendidih yang sangat tinggi.
Mereka padat pada suhu bilik
Oleh kerana fakta yang sama mempunyai titik gabungan yang tinggi, semua oksida asas adalah pepejal pada suhu bilik.
Mereka adalah sebatian asas
Sebab mengapa mereka dipanggil oksida asas adalah tepat kerana sifat asidnya. Oksida dengan watak ionik yang lebih besar menghasilkan penyelesaian asas apabila melarutkan air dan juga bertindak balas dengan asid, meneutralkannya.
Walau bagaimanapun, perlu diperhatikan bahawa tidak semua oksida logam adalah asas. Ada yang neutral, asid lain dan amphotor lain.
Kebanyakannya sedikit larut atau tidak larut di dalam air
Semua oksida asas tidak larut dalam air, kecuali oksida alkali dan barium oksida. Walau bagaimanapun, mereka larut dalam penyelesaian asid.
Bagaimana oksida asas?
Oksida asas boleh dibentuk secara spontan apabila logam terdedah kepada oksigen udara. Malah, lapisan kakisan yang terbentuk di permukaan logam terdiri daripada oksida asas yang berbeza.
Logam yang terlibat, secara umum ia adalah alkali, logam alkali atau logam peralihan.
Anda boleh menulis tiga reaksi umum untuk pembentukan oksida, bergantung kepada sama ada logam Valencia adalah atau ganjil:
Untuk logam dengan nilai ganjil:
Apabila logam mempunyai valensi ganjil, tindak balas umum pembentukan oksida adalah:

Sebagai contoh, untuk pembentukan natrium oksida, di mana natrium mempunyai Valencia +1, reaksi adalah:
Ia boleh melayani anda: fosforus: sejarah, sifat, struktur, mendapatkan, menggunakan
Contoh lain ialah pembentukan oksida ferrik, di mana besi mempunyai pengoksidaan atau valencia +3. Dalam kes ini, reaksi adalah:

Untuk logam dengan Valencia +2:
Apabila logam mempunyai Valencia +2, tindak balas umum pembentukan oksida adalah:

Sebagai contoh, dalam hal pembentukan kalsium oksida, di mana kalsium mempunyai Valencia +2, reaksi adalah:

Untuk logam dengan pasangan lain:
Apabila logam mempunyai valensi selain +2, tindak balas umum pembentukan oksida adalah:
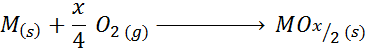
Contoh kes ini ialah tindak balas pembentukan titanium oksida (iv):

Nomenklatur oksida asas
Terdapat tiga sistem tatanama untuk oksida asas yang: tatanama tradisional, stok dan sistematik.
Untuk menamakan oksida mengikut dua sistem tatanama yang pertama, perlu mengetahui logam Valencia, sementara untuk yang terakhir.
Nomenclature tradisional
Menurut tatanama tradisional, oksida asas dinamakan bermula dengan perkataan Sama adaXido diikuti dengan nama kation. Nama terakhir ini dibina dengan meletakkan akar nama logam dan sistem awalan dan akhiran yang ditunjukkan oleh logam Valencia:
Oksida + Awalan-raí-sufijo
Peraturan untuk memberikan awalan dan akhiran diringkaskan dalam jadual berikut:
Bilangan kemungkinan nilai | Valencia | Awalan | Akhiran |
1 Valencia tunggal | |||
Hanya | --- | ___ico | |
2 Valencias | |||
Orang tua | --- | ___ico | |
Kecil | --- | ___bear | |
3 Valensi | |||
Orang tua | --- | ___ico | |
Pertengahan | --- | ___bear | |
Kecil | Hiccup___ | ___bear | |
4 Valensi | |||
Orang tua | Per___ | ___ico | |
Pertengahan utama | --- | ___ico | |
Pertengahan kecil | --- | ___ico | |
Kecil | Hiccup___ | ___ico |
Contoh:
Dia Iman2Sama ada3 Ia adalah oksida besi dengan valencia +3. Besi hanya mempunyai dua valensi yang +2 dan +3, jadi dalam oksida ini besi mempunyai dua valensi tertua. Atas sebab ini, akhiran ditambah ___ico di akar nama logam besi yang Ferr-.
Ia boleh melayani anda: tiada elektrolit: ciri dan contohOleh itu, nama tradisional Iman2Sama ada3 adalah: Ferric Oxide.
Nomenclature stok
Dalam sistem ini, nama dibina bermula dengan kata -kata oksida dari, diikuti dengan nama logam. Akhirnya, Valencia diletakkan dalam nombor Rom dalam kurungan:
Logam + nama oksida (Valencia)
Sekiranya logam hanya mempunyai satu valensi, ia ditinggalkan.
Contoh:
Dalam Cr2Sama ada3 Chromium mempunyai Valencia +3, jadi stok nama Chrome Oxide (III).
Nomenklatur sistematik
Ini adalah satu -satunya daripada tiga nomenclatures yang tidak menentukan logam Valencia. Nama sitematik menunjukkan berapa banyak atom oksigen dan logam yang mengandungi sebatian menggunakan awalan berangka.
Nama dibina dengan perkataan oksida didahului olehnya awalan yang menunjukkan bilangan oksigen, Kemudian artikel itu dari diikuti oleh Nama logam dengan awalan masing -masing.
Awalan-oksida + + awalan logam
Beberapa awalan adalah:
Nombor | Awalan |
1 | Roti |
2 | Memberi |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Contoh:
Dalam tatanama sistematik, CR2Sama ada3 Ia dipanggil dichroma trioksida, kerana ia mempunyai tiga oksigen dan dua kromo.
Contoh oksida asas
- Natrium oksida - na2Sama ada
- Ferric Oxide - Iman2Sama ada3
- Besi monoksida - jelek
- CROMIC OXIDE - CR2Sama ada3
- Divanadio Pentaoxide - V2Sama ada5
- Potassium Oxide - k2Sama ada
- Barium Oxide - Bao

