Oksida bukan logam

- 1143
- 291
- Ismael Turner
 Karbon dioksida adalah gas rumah hijau dan juga oksida bukan logam
Karbon dioksida adalah gas rumah hijau dan juga oksida bukan logam Apakah oksida bukan logam?
The oksida bukan logam Mereka adalah sebatian binari yang terbentuk di antara keadaan bukan -logam dengan keadaan pengoksidaan positif dan oksigen dengan keadaan pengoksidaan -2. Juga dipanggil anhydrides dan asid oksida, sebatian ini cenderung membentuk penyelesaian asid dengan membubarkannya di dalam air, dan juga cenderung bertindak balas dengan oksida asas untuk membentuk garam oksal.
Oksida bukan logam sangat biasa. Malah, mereka ada di mana -mana. Air, cecair penting yang meliputi dua pertiga permukaan bumi, adalah oksida bukan logam. Begitu juga karbon dioksida yang kami menghembus nafas semasa pernafasan dan oksida sulfur kami yang mencemarkan udara dan yang menyebabkan hujan asid.
Dibentuk oleh bukan logam dan oksigen (yang juga bukan metal), pautan yang menyatukan atom mereka adalah ikatan kovalen, dalam kebanyakan kes kutub. Atas sebab ini, sebahagian besar oksida bukan metal atau anhydrid mempunyai titik mendidih yang sangat rendah, dan kebanyakannya adalah gas pada suhu bilik.
Sifat oksida bukan logam
- Mereka tidak mempunyai kilauan atau bersinar logam.
- Mereka boleh mempunyai warna yang berbeza.
- Atom mereka bersatu dengan ikatan kovalen dan bukannya pautan ionik.
- Mereka dibentuk oleh oksigen dan bukan metal.
- Berbanding dengan oksida logam, mereka biasanya mempunyai titik lebur dan mendidih yang rendah, walaupun sangat pelbagai.
- Kebanyakannya adalah gas, tetapi juga boleh didapati dalam keadaan pepejal (seperti n2Sama ada3) atau cecair pada suhu bilik.
- Oksida bukan logam pepejal biasanya rapuh dan boleh mengalami kekerasan yang berbeza.
- Mereka adalah konduktor haba dan elektrik yang buruk.
- Apabila membubarkannya di dalam air, mereka bertindak balas untuk membentuk asid oksasid.
- Sebilangan asid oksasidnya adalah asid kuat yang cenderung membentuk anion atau oksion dalam larutan akueus.
- Mereka bertindak balas dengan oksida asas untuk membentuk garam oksal.
Jenis oksida bukan logam
Tidak ada klasifikasi formal atau universiti yang diterima oleh oksida bukan logam. Walau bagaimanapun, ini boleh dikumpulkan mengikut sifat asid mereka.
Walaupun oksida bukan logam juga dipanggil oksida asid, tidak semuanya selalu bertindak balas sebagai asid terhadap sebatian lain. Memandangkan ini, tiga jenis oksida bukan logam boleh dikenalpasti mengikut sifat asid/asas mereka:
Oksida asid bukan logam
Mereka adalah yang paling biasa. Sebilangan besar sebatian antara oksigen dan lain -lain bukan logam, tanpa mengira status pengoksidaan mereka, menghasilkan asid mineral apabila membubarkannya ke dalam air, menimbulkan penyelesaian asid.
- Beberapa contoh oksida asid adalah anhidrida nitrik (n2Sama ada5) dan anhydride sulfur (begitu3).
Oksida bukan logam neutral
Beberapa oksida bukan logam tidak bertindak balas dengan air sama sekali apabila melarutkan di dalamnya. Dalam kes ini, penyelesaian yang dihasilkan adalah neutral (ia tidak berasid atau asas).
- Beberapa contoh oksida neutral adalah karbon monoksida (CO), nitrous oksida (N₂O) dan klorin dioksida (CLO2).
Oksida amphotorous bukan -logam
Istilah Anfótero Ia merujuk kepada keupayaan sebatian kimia untuk berkelakuan sebagai asid atau sebagai asas, bergantung kepada siapa yang bertindak balas. Iaitu, ini adalah sebatian yang kedua -dua asid dan asas pada masa yang sama.
- Antara oksida bukan logam amfotik, yang paling biasa ialah air (h2Sama ada). Air adalah amphotent, kerana ia dapat memberikan proton ke pangkalan (bertindak sebagai asid), tetapi ia juga dapat menerima proton asid (bertindak sebagai pangkalan).
Contoh oksida bukan logam
Oksida bukan metallic yang paling biasa bagi setiap bukan logam dibentangkan di bawah, bersama -sama dengan formula molekulnya, namanya menurut tatanama sistematik IUPAC, menurut tatanama saham dan menurut tatanama tradisional:
Karbon oksida
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
Co | Karbon monoksida | Karbon oksida (ii) | Anhydride karbon |
CO2 | Karbon dioksida | Karbon oksida (iv) | Anhydride karbonik |
Nitrogen oksida
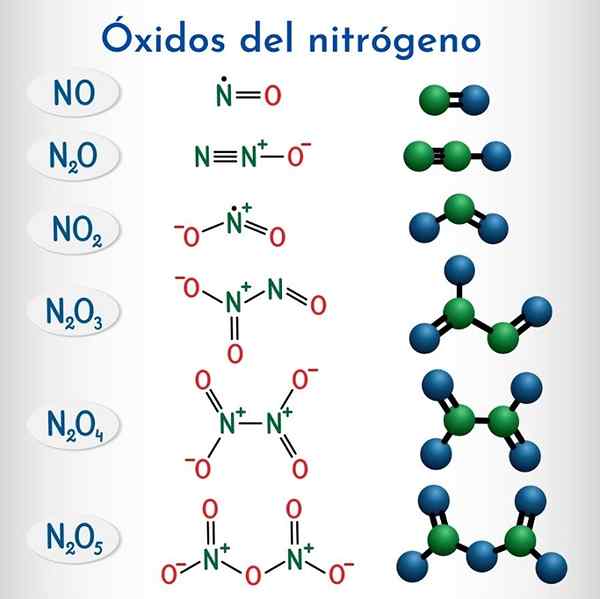 Formula dan struktur 6 oksida nitrogen bukan logam
Formula dan struktur 6 oksida nitrogen bukan logam Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
N2o | Dinitrogen monoksida | Nitrogen oksida (i) | Nitrous oksida (Hiponitroso anhydride) |
Tidak | Nitrogen monoksida | Nitrogen oksida (II) | Nitrik oksida |
N2O3 | Dinitrogen Trioxide | Nitrogen oksida (iii) | Nitrous anhydride |
N2O4 | Dinitrogen Tetraxide | Nitrogen oksida (iv) | Nitrogen tetraxide |
NO2 | Nitrogen dioksida | Nitrogen oksida (iv) | Nitrogen dioksida |
N2O5 | Dinitrogen Pentaoxide | Nitrogen oksida (V) | Nitric anhydride |
Fosforus oksida
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
P2O3 | Diphosphacking trioksida | Fosforus oksida (III) | Anhydride fosforus |
P2O5 | Diphosphack pentaoxide | Fosforus oksida (V) | Anhydride fosforik |
P2O4 | Diphosphack Tetraxide | Fosforus oksida (III, V) | --- |
Oksida arsenik
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
AS2O3 | Diarsenic trioksida | Arsenik oksida (iii) | Arsenioso anhydride |
AS2O5 | Diarsenic Pentaoxide | Arsenik oksida (v) | Arsenik anhydride |
Antimoni oksida
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
SB2O3 | Diantioni trioksida | Antimoni oksida (iii) | Antimonious anhydride |
SB2O5 | DiantiMony penoxide | Antimoni oksida (v) | Antimonik anhydride |
Sulfur oksida
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
SW | Sulfur monoksida | Sulfur Oxide (II) | Hyposulfurous anhydride |
So2 | Sulfur dioksida | Sulfur oksida (iv) | Sulfur anhydride |
So3 | Sulfur trioksida | Sulfur Oxide (VI) | Sulfurik anhydride |
Selenium oksida
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
Seo | Selenium monoksida | Selenium oksida (ii) | Anhydride hipiplolen |
Seo2 | Selenium dioksida | Selenium oksida (iv) | Selenary Anhydride |
Seo3 | Selenium trioksida | Selenium oksida (vi) | Selénic Anhydride |
Telurio Oxides
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
Teo | Telurio monoksida | Telurio Oxide (II) | Anhydride hypelur |
TEO2 | Telurio dioksida | Telurio Oxide (IV) | Anhydride telur |
TEO3 | Telurio trioksida | Telurio Oxide (VI) | Telluric Anhydride |
Oksida klorin
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
Cl2o | Klorin monoksida | Klorin oksida (i) | Hypoclorous anhydride |
Cl2o3 | Klorin trioksida | Klorin oksida (iii) | Chloro Anhydride |
Cl2o5 | Klorin penoxide | Klorin oksida (V) | Anhydride klorik |
Cl2o7 | Heptoksida klorin | Klorin oksida (vii) | Perchloric anhydride |
Bromine Oxides
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
Br2o | Bromine monoksida | Bromine Oxide (i) | Anhydride hipobromous |
BR2O3 | Bromine trioksida | Bromine Oxide (III) | Bromous anhydride |
Br2o5 | Bromine Pentaoxide | Bromine Oxide (V) | Bromic anhydride |
BR2O7 | Bromine heptaoxide | Bromine Oxide (vii) | Perbomik anhydride |
Oksida iodin
Formula | Nama sistematik IUPAC | Nomenclature stok | Nama tradisional |
I2o | Iodine monoksida | Oksida iodin (i) | Hypoyodoso anhydride |
I2O3 | Iodin trioksida | Oxide iodin (III) | Yodoso anhydride |
I2o5 | Iodin penoxide | Oksida iodin (V) | Yodium anhydride |
I2o7 | Heptoksida iodin | Oksida iodin (vii) | Periódicoic anhydride |

