Struktur Iodida, Hartanah, Memperoleh, Menggunakan, Menggunakan,

- 4998
- 653
- Ms. Micheal Rippin
Dia Lead Iodide Ia adalah sebatian bukan organik yang dibentuk oleh elemen utama (PB) dalam pengoksidaannya +2 dan iodin (i) dengan Valencia -1. Formula kimianya adalah KDNK2. Ia adalah sebatian toksik. Kerana ia memimpin berbahaya kepada manusia, haiwan dan ekosistem semulajadi. Di samping itu, iodida juga boleh menyebabkan beberapa penyakit.
Kompaun KDNK4, Ini, dengan plumbum dalam pengoksidaan +4, nampaknya ia tidak wujud, mungkin disebabkan oleh kapasiti pengurangan ion iodida (i-). KDNK2 Ia adalah warna kuning pepejal sedikit larut dalam air.
 Lead Iodide (KDNK2) pepejal. W. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons.
Lead Iodide (KDNK2) pepejal. W. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0). Sumber: Wikimedia Commons. Ia boleh diperoleh dengan menggunakan tindak balas pertukaran ion antara garam iodida dan plumbum yang larut dalam air.
Ia mempunyai sifat semikonduktor, jadi kebanyakan aplikasi semasa berada dalam peranti fotovoltaik, pengesan radiasi dan sensor tertentu.
Salah satu penggunaan yang paling dikaji dalam sebatian ini ialah sel solar perovskita, yang telah terbukti sangat cekap dan kos rendah.
[TOC]
Struktur
Dalam Iodida Lead Kesatuan antara atomnya hanya ionik. Atom membentuk lapisan dengan struktur heksagon dan mereka dikaitkan antara satu sama lain melalui daya lemah van der waals.
Kekuatan ini bukan ionik atau kovalen, adalah interaksi lemah antara lapisan elektronik atom.
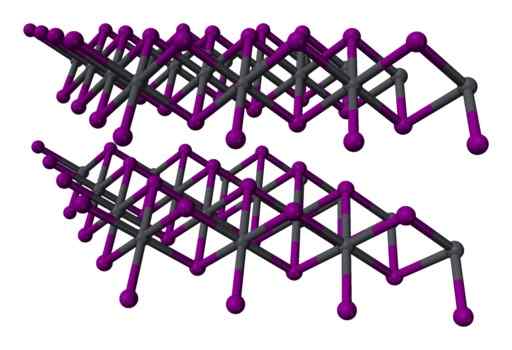 Struktur Tiga Tiga Layer2 kristal. Kelabu = plumbum; Violet = Iodine. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons.
Struktur Tiga Tiga Layer2 kristal. Kelabu = plumbum; Violet = Iodine. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons. Nomenclature
- Lead Iodide
- Lead Iodide (II)
- Lead Diyoduro
- Plumboso iodide
Sifat
Keadaan fizikal
Pepejal kristal kuning terang. Kristal heksagon.
 Kristal heksagon iodida plumbum. Alessandro E Damiano/CC oleh (https: // creativeCommons.Org/lesen/by/4.0). Sumber: Wikimedia Commons.
Kristal heksagon iodida plumbum. Alessandro E Damiano/CC oleh (https: // creativeCommons.Org/lesen/by/4.0). Sumber: Wikimedia Commons. Berat molekul
461 g/mol
Takat lebur
410 ºC
Takat didih
954 ° C, rebus dengan penguraian.
Ketumpatan
6.16 g/cm3
Kelarutan
Larut air ringan: 0.076 g/100 ml pada 25 ° C. Larut air panas. Tidak larut dalam alkohol dan asid hidroklorik sejuk (HCL).
Boleh melayani anda: natrium: sejarah, struktur, sifat, risiko dan kegunaanSifat kimia
Sifat pengoksidaan dan pengurangannya lemah. Walau bagaimanapun, anda boleh membentangkan tindak balas oksidenuksi.
Walaupun ia sangat larut dalam air larut dalam larutan pekat iodida alkali seperti kalium iodida (ki). Ia larut dalam larutan pekat natrium asetat (CH3Poket). Ia larut dengan bebas dalam larutan natrium thiosulfate (NA2S2Sama ada3).
Beberapa penulis menunjukkan bahawa di dalam air PBI ion dapat dihasilkan+ Dan jika terdapat ion ion berlebihan (i-) spesies yang lebih kompleks seperti KDNK boleh dibentuk3- dan KDNK42-, antara yang lain.
Ia tidak mudah terbakar.
Sifat fizikal lain
Ia bertindak sebagai semikonduktor, iaitu, ia mungkin atau tidak boleh menjalankan elektrik bergantung pada keadaan yang ditakluk.
Ia adalah semikonduktor jurang langsung, iaitu, untuk salah satu elektronnya lulus dari band Valencia untuk memandu, ia hanya mempunyai jumlah tenaga yang sama.
Oleh kerana bilangan atom yang tinggi unsurnya (pb = 82, i = 53) ia mempunyai kapasiti fotoelektrik yang tinggi. Band Gap 2.5 yang pernah membolehkan persembahan fotovoltaik kecekapan tinggi pada suhu sehingga 250 ° C.
Memperoleh
Ia boleh disediakan dengan bertindak balas sebatian larut air dengan asid iarhydic (HI) atau dengan iodida logam larut. Sebagai contoh, larutan akueus asetat plumbum dengan kalium iodida bercampur:
PB (Ch3COO)2 + 2 ki → KDNK2↓ + 2 k (pilih3COO)
Reaksi jenis ini dikenali sebagai "pertukaran ion" kerana kation dan anion ditukar antara garam.
Dalam contoh yang disebutkan, kalium asetat sangat larut dalam air dan masih dibubarkan, sementara kalium iodida, kurang larut, mendakan dan penapis. Pembersihan dilakukan dengan menyusun semula sebatian di dalam air.
Boleh melayani anda: penghabluranPemendakan PBI2 Ia dapat dilihat dalam imej berikut yang menunjukkan tiub ujian di mana nitrat plumbum (ii) (pb (tidak3)2) dan kalium iodida (ki) dalam larutan akueus. Kesan ini dipanggil "Emas Emas".
 Hujan emas dari KDNK2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Hujan emas dari KDNK2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Aplikasi
Sebagai semikonduktor
Ia digunakan sebagai pengesan untuk foton tinggi seperti x -rays dan sinar gamma. Ia boleh digunakan dalam peranti fotovoltaik, fotokel, lampu LED, pengesan optik dan klasifikasi dan sensor biologi.
Sekiranya diperkenalkan ke dalam struktur nano, ia boleh digunakan dalam fotokatalisis dan sel solar. Di samping itu, banyak nanopartikel KDNK2 Mereka mempunyai sifat luminescent.
 Iodida plumbum digunakan dalam pengesan perubatan x -ray. Pengarang: lkcjjang40090. Sumber: Pixabay.
Iodida plumbum digunakan dalam pengesan perubatan x -ray. Pengarang: lkcjjang40090. Sumber: Pixabay. Sel solar
KDNK2 Ia adalah perantara dalam sintesis perovskitas yang ditakdirkan untuk sel solar. Jenis sel fotovoltaik ini mengandungi methylammonium dan iodida plumbum (pilih3NH3KDNK3) Berdasarkan bapa saudara2.
Peranti sedemikian mempunyai kecekapan yang tinggi dan kos rendah, jadi mereka banyak belajar dan penyelidikan.
 Sel suria di bumbung rumah di lapangan. Sel solar di mana PBI digunakan2 Mereka sangat cekap dan tidak terlalu mahal, jadi mereka boleh digunakan di rumah pada masa akan datang. Pengarang: Manfred Antranias Zimmer. Sumber: Pixabay.
Sel suria di bumbung rumah di lapangan. Sel solar di mana PBI digunakan2 Mereka sangat cekap dan tidak terlalu mahal, jadi mereka boleh digunakan di rumah pada masa akan datang. Pengarang: Manfred Antranias Zimmer. Sumber: Pixabay. Walau bagaimanapun, sejak Cho3NH3KDNK3 Ia boleh rosak dengan air hujan, telah dikaji bagaimana mencemarkan sel -sel ini boleh kedua -duanya apabila mereka sedang digunakan dan apabila dibuang.
Ch3NH3KDNK3 Apabila bersentuhan dengan air, ia pecah menjadi methylamine (pilih3NH2), Asid yodhydric dan KDNK2. Yang terakhir, walaupun ia sedikit larut dalam air, dari masa ke masa dapat melepaskan jumlah dari pb ion toksik2+.
Kajian tidak konklusif, kerana tempat di mana pelepasan plumbum berlaku untuk menentukan sama ada jumlahnya boleh berbahaya dalam jangka pendek. Sebaliknya, pelepasan yang berterusan dapat bioaccumulate dan sangat berbahaya.
Boleh melayani anda: butanone: struktur, sifat dan kegunaanAplikasi lain
- Ia ditaburkan dalam bentuk semburan di awan untuk menghasilkan hujan.
- Dalam penapis untuk astronomi inframerah jauh.
- Dalam fotografi, tayangan, filem untuk merakam imej optik, emulsi fotografi.
- Dalam salutan brek. Dalam lemak pelincir.
- Lampu arka stim merkuri. Pada kertas elektrotik.
- Bahan termoelektrik, bateri terma dengan iodin.
Risiko
Untuk keselamatan
Ia mesti disimpan jauh dari oksidan seperti peroksida, peroksida, permanganat, kloris dan nitrat. Hubungi dengan logam aktif kimia seperti kalium, natrium, magnesium dan zink juga harus dielakkan. Dalam semua kes ini reaksi ganas boleh berlaku.
Sekiranya anda menjalani pemanasan, gas beracun plumbum dan yodium dijana.
Untuk kesihatan
Sangat berbahaya kepada manusia. Oleh itu, ia adalah karsinogen untuk haiwan, oleh itu, ia juga dapat disimpulkan bahawa ia juga untuk manusia.
Ia boleh menyebabkan sakit kepala, kerengsaan, mengurangkan ingatan dan mengganggu tidur. Lead yang terkandung dalam sebatian ini dapat menghasilkan kerosakan kekal pada buah pinggang, otak, saraf, sel darah dan risiko tekanan tinggi.
Ia mesti dikendalikan sebagai teratogen (sebatian yang dapat menghasilkan kecacatan kongenital). Ia juga boleh menghasilkan iodisme, yang gejala kesesakan hidung, sakit kepala, kerengsaan membran mukus dan letusan kutaneus, antara lain.
Untuk persekitaran semula jadi
Ia diklasifikasikan sebagai bahan pencemar toksik. Ia mesti disimpan dari air dan sumber longkang. Untuk mengelakkan pencemaran dice harus dibina apabila perlu untuk mengekalkannya.
Ia sangat toksik kepada kehidupan akuatik dengan kesan yang terakhir dari masa ke masa, kerana ia boleh dibinasakan.
Rujukan
- Memimpin, d.R. (Editor) (2003). Buku Panduan Kimia dan Fizik CRC. 85th CRC Press.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Lead Iodide. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Sintesis dan pencirian PVP/PBI2. Adv Compos Hibrid Mater 3, 49-57 (2020). Pautan pulih.Springer.com.
- Ismail, r.Ke. et al. (2016). Sintesis PBI2 Nanopartikel oleh ablasi laser dalam metanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Pautan pulih.Springer.com.
- Bahan. (2013). Lead Iodide (KDNK2) Semikonduktor. Pulih dari Azom.com.
- CDH (2008). Memimpin (ii) iodida. Bahan lembaran data keselamatan. Pulih dari chdfinechemical.com.
- Hailegnaw, b. et al. (2015). Hujan pada perovskit berasaskan iodida methylammonium: kemungkinan kesan alam sekitar sel suria perovskite. J. Phys. Chem. Lett. 2015, 6, 9, 1543-1547. Pulih dari pub.ACS.org.
- Yayasan Wikimedia (2020). Memimpin (ii) iodida. Diambil dari.Wikipedia.org.
- « Lead Struct, sifat, memperoleh, menggunakan, menggunakan
- Organisasi syarikat objektif, struktur, contoh »

