50 contoh asid dan pangkalan

- 3484
- 929
- Ms. Edgar Carroll
Terdapat beratus -ratus Contoh asid dan pangkalan yang boleh didapati di semua cabang kimia, tetapi secara keseluruhannya mereka dipisahkan menjadi dua keluarga besar: bukan organik dan organik. Asid bukan organik biasanya dikenali sebagai asid mineral, dicirikan dengan sangat kuat berbanding dengan organik.
Asid dan pangkalan difahami sebagai bahan yang mempunyai perisa atau saponáceos, masing -masing. Kedua -duanya menghakis, walaupun perkataan 'kaustik' biasanya digunakan untuk pangkalan yang kuat. Ringkas akaun: mereka membakar dan menjalankan kulit jika mereka menyentuhnya. Ciri -cirinya dalam media pelarut telah menjadualkan satu siri definisi sepanjang sejarah.
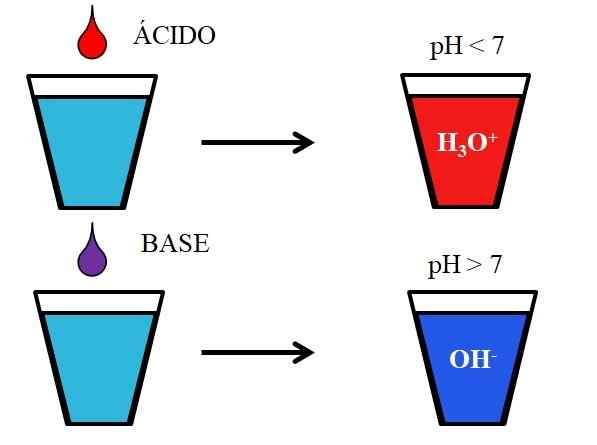 Tingkah laku asid dan pangkalan apabila dibubarkan di dalam air. Sumber: Gabriel Bolívar.
Tingkah laku asid dan pangkalan apabila dibubarkan di dalam air. Sumber: Gabriel Bolívar. Imej yang lebih rendah menunjukkan tingkah laku generik asid dan asas apabila ditambah atau dibubarkan dalam gelas dengan air. Asid menghasilkan penyelesaian dengan nilai pH di bawah 7 disebabkan oleh ion hidronios, h3Sama ada+; Walaupun pangkalan menghasilkan penyelesaian dengan pH di atas 7 kerana ion hidroksil (atau oxydril), oh-.
Sekiranya kita menambah asid hidroklorik, HCl (drop merah), ke kaca, akan ada ion H3Sama ada+ dan Cl- terhidrasi. Sebaliknya, jika kita mengulangi percubaan dengan natrium hidroksida, NaOH (drop ungu), kita akan mempunyai ion oh- dan na+.
[TOC]
Definisi

Ciri -ciri, semakin dikaji dan difahami, asid dan pangkalan menetapkan lebih daripada satu definisi untuk sebatian kimia ini. Di antara definisi ini kita mempunyai Arrhenius, iaitu Bronsted-Lowry, dan akhirnya Lewis. Sebelum memetik contoh -contoh yang diperlukan untuk jelas ini.
Arrhenius
Asid dan pangkalan, menurut Arrhenius, adalah mereka yang dibubarkan dalam air menghasilkan ion3Sama ada+ atau oh-, masing -masing. Iaitu, imej sudah mewakili definisi ini. Walau bagaimanapun, dengan sendirinya ia menghina beberapa asid atau pangkalan yang terlalu lemah untuk menghasilkan ion tersebut. Di sinilah definisi Bronsted-Lowry memasuki.
Boleh melayani anda: asid: ciri dan contohBronsted-lowry
Asid Bronsted-Lowry adalah mereka yang boleh menderma ion h+, Dan pangkalannya adalah mereka yang menerima h ini+. Sekiranya asid menyumbangkan dengan mudah+, Ini bermaksud bahawa ia adalah asid yang kuat. Begitu juga untuk pangkalan, tetapi menerima h+.
Oleh itu, kita mempunyai asid dan asas yang kuat atau lemah, dan daya mereka diukur dalam pelarut yang berbeza; terutamanya di dalam air, di mana unit pH yang diketahui ditubuhkan (dari 0 hingga 14).
Oleh itu, asid yang kuat akan menyumbangkan h sepenuhnya+ ke air dalam reaksi jenis:
Ha + h2O => a- + H3Sama ada+
Kemana- Ia adalah pangkalan ha yang konjugasi. Dari sini oleh itu datang h3Sama ada+ hadir di kaca dengan larutan asid.
Sementara itu, asas B yang lemah tidak akan dilindungi air untuk mendapatkan h masing -masing+:
B + h2Atau hb + oh-
Di mana Hb adalah asid konjugasi b. Inilah kes ammonia, NH3:
NH3 + H2Atau NH4+ + Oh-
Pangkalan yang sangat kuat boleh menderma secara langsung ion- tidak perlu bertindak balas dengan air; Seperti NaOH.
Lewis
Akhirnya, asid Lewis adalah yang memenangi atau menerima elektron, dan pangkalan Lewis adalah mereka yang menderma atau kehilangan elektron.
Contohnya, asas NH Bronsted-Lowry3 Ia juga merupakan pangkalan Lewis, kerana atom nitrogen menerima H+ Dengan mendermakan ini pasangan elektron percuma (h3N: h+). Itulah sebabnya ketiga -tiga definisi tidak bersetuju antara satu sama lain, tetapi mereka menjalin hubungan dan membantu mengkaji keasidan dan asas dalam spektrum sebatian kimia yang lebih luas.
Boleh melayani anda: nikel: sejarah, sifat, struktur, kegunaan, risikoContoh asid
Setelah menjelaskan definisi, satu siri asid akan disebutkan di bawah dengan formula dan nama masing -masing:
-HF: Asid Fluorhydric
-HBR: Asid Bromhydric
-Hai: asid yodhydric
-H2S: Asid sulfhydric
-H2SE: Asid Seleenhydric
-H2TE: Asid Telurhydric
Ini adalah asid binari, juga dipanggil hydraceids, yang dimiliki oleh asid hidroklorik yang disebutkan di atas, HCl.
-Hno3: asid nitrik
-Hno2: Asid nitrous
-Hno: asid hiponitrik
-H2Co3: Asid karbonik
-H2Co2: asid karbonoso, yang sebenarnya dikenali lebih banyak dengan nama asid formik, HCOOH, asid organik yang paling mudah dari semua
-H3PO4: asid fosforik
-H3PO3 atau h2[HPO3]: Asid fosfor, dengan ikatan H-P
-H3PO2 atau h [h2PO2]: Asid hypophospheric, dengan dua ikatan H-P
-H2SW4: asid sulfurik
-H2SW3: Asid sulfur
-H2S2Sama ada7: asid disulfurik
-Hio4: asid periódic
-Hio3: Asid yodium
-Hio2: asid iodose
-Hio: asid hypoyodoso
-H2Cro4: Asid kromik
-Hmno4: Asid mangan
-Ch3COOH: asid asetik (cuka)
-Ch3SW3H: Asid metanosulfonik
Semua asid ini, kecuali formik dan dua yang terakhir, dikenali sebagai Oxácidos atau Asid Ternary.
Yang lain:
-ALCL3: Aluminium chloride
-FECL3: Ferric Chloride
-Bf3: Boro trifluoruro
-Kation logam dibubarkan di dalam air
-Carbocations
-H (ChbsebelasClsebelas): Carborano asid super
- FSO3H: Asid fluorosulfonik
- HSBF6: Fluoroantimonic Acid
- FSO3H · SBF5: Asid sihir
Empat contoh terakhir membentuk asid super yang menakutkan; sebatian yang mampu memecah hampir apa -apa bahan dengan hampir tidak menyentuhnya. ALCL3 Ini adalah contoh asid Lewis, kerana pusat logam aluminium mampu menerima elektron kerana kekurangan elektroniknya (ia tidak melengkapkan oktet Valencia).
Boleh melayani anda: Mercury hidroksida: struktur, sifat, kegunaan, risikoContoh pangkalan
Di antara pangkalan bukan organik kita mempunyai hidroksida logam, seperti natrium hidroksida, dan beberapa hidurns molekul, seperti ammonia sudah disebutkan. Berikut adalah contoh lain asas:
-KOH: Potassium Hydroxide
-Lioh: lithium hidroksida
-RBOH: Rubidio Hydroxide
-CSOH: Cesium hidroksida
-Froh: Francio Hydroxide
-Jadilah (oh)2: Beryl Hydroxide
-Mg (oh)2: Magnesium hidroksida
-CA (oh)2: Kalsium hidroksida
-Sr (oh)2: Strontium hidroksida
-BA (oh)2: Barium hidroksida
-Ra (oh)2: Radio hidroksida
-Iman (oh)2: Ferrous hidroksida
-Iman (oh)3: Ferric Hydroxide
-Al (oh)3: Aluminium hidroksida
-PB (OH)4: Plúmbic hidroksida
-Zn (oh)2: zink hidroksida
-CD (OH)2: Cadmium hidroksida
-Cu (oh)2: Cupric Hydroxide
-Ti (oh)4: Titanic Hydroxide
-Ph3: fosfin
-Abu3: Arsina
-Nanh2: Natrium amiduro
- C5H5N: Pyridine
-(Ch3) N: trimethylamine
- C6H5NH2: Phenylamine atau aniline
-NAH: Natrium hidrida
-KH: Potassium Hydride
-Karbohidrat
-Li3N: lithium nitride
-Alcoxides
-[(Ch3)2Ch]2NLI: Diisopropilamide litium
-DietInilbenzene Anion: C6H4C42- (Pangkalan terkuat yang diketahui setakat ini)
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Naomi Hennah. (10 Oktober 2018). Cara Mengajar Asid, Pangkalan dan Garam. Pulih dari: edu.RSC.org
- Helmestine, Anne Marie, Ph.D. (31 Ogos 2019). Formula asid dan pangkalan biasa. Pulih dari: Thoughtco.com
- David Wood. (2019). Bandingkan Asid & Pangkalan Biasa. Kajian. Pulih dari: belajar.com
- Ross Pomeroy. (23 Ogos 2013). Asid terkuat di dunia: Seperti api dan ais. Pulih dari: realclearscience.com
- Wikipedia. (2019). Diethynylbenzene dianion. Diperoleh dari: dalam.Wikipedia.org
- « Simbol diameter dan formula, bagaimana untuk mengeluarkannya, lilitan
- Ekofisiologi Apa Kajian dan Aplikasi dalam Haiwan dan Sayuran »

