Ciri -ciri Actin, Struktur, Filamen, Fungsi
- 1130
- 135
- Ismael Turner
The Actin Ia adalah protein sitosolik yang membentuk mikrofilam. Dalam eukariota, actin adalah salah satu protein yang paling banyak. Sebagai contoh, ia mewakili 10% berat daripada jumlah protein dalam sel -sel otot; dan antara 1 dan 5% daripada protein dalam sel -sel bukan -muscle.
Protein ini, di sebelah filamen pertengahan dan microtubules, membentuk sitoskeleton, yang fungsi utamanya adalah mobiliti sel, penyelenggaraan bentuk sel, pembahagian sel dan pergerakan organel dalam tumbuh -tumbuhan, kulat dan haiwan.
 Sumber: sarcomere.SVG: David Richfield (pengguna Slashme) Kerja Derivatif: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]
Sumber: sarcomere.SVG: David Richfield (pengguna Slashme) Kerja Derivatif: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]] Isoforms cytoskelet actin.
Dari sudut pandangan evolusi, actin adalah protein yang sangat terpelihara. Terdapat kira -kira 90% homologi urutan dalam spesies yang berbeza. Dalam organisma uniselular, satu gen menyandi actin isaform. Semasa dalam organisma multiselular, gen yang berbeza menyandikan pelbagai actin isaforms.
Actin, bersama -sama dengan myosin, adalah struktur penting dalam masa depan evolusi organisma eukariotik dan kepelbagaian mereka, kerana mereka membenarkan pergerakan tanpa struktur lain, seperti Flagella dan Cilia.
[TOC]
Struktur: Filamen Actin
Actin adalah protein globular rantai polipeptida tunggal. Dalam otot, actin mempunyai jisim molekul kira -kira 42 kDa.
Protein ini mempunyai dua domain. Masing -masing mempunyai dua subdomain, dan celah di antara domain. ATP-MG+2 menyertai bahagian bawah celah. Terminal amino dan carboxil bersatu di subdomain 1.
Actina g dan actina f
Terdapat dua bentuk actin utama: monomer actin, yang dipanggil actina g; dan polimer filamen, terdiri daripada monomer actin g, yang dipanggil actina f. Filamen Actin, yang diperhatikan oleh mikroskopi elektronik, mempunyai kawasan sempit dan luas, masing -masing 7 nm dan 9 nm diameter.
Sepanjang filamen, monomer actin membentuk helix berganda. Satu unit yang diulang sepanjang filamen terdiri daripada 13 kipas dan 28 monomer actin, dan mempunyai jarak 72 nm.
Filamen Actin mempunyai dua hujung. Satu membentuk celah yang menghubungkan ATP-Mg+2, yang terletak di arah yang sama dalam semua monomer actin filamen, yang dipanggil akhir (-); Dan hujung yang lain adalah sebaliknya, dipanggil akhir (+). Oleh itu, dikatakan bahawa filamen actin mempunyai polaritas.
Banyak kali komponen ini dikenali sebagai mikrofilamen, kerana ia adalah komponen sitoskeleton yang menunjukkan kurang diameter.
Di mana kita dapati actin?
Actin adalah protein yang sangat biasa dalam organisma eukariotik. Dari semua protein sel, actin mewakili kira -kira 5 hingga 10% - bergantung pada jenis sel. Di hati, sebagai contoh, setiap sel yang membentuknya hampir 5.108 Molekul actin.
Ciri -ciri
Dua bentuk actin, monomer dan filamen terus dijumpai dalam keseimbangan dinamik antara pempolimeran dan depolimer. Secara umum, terdapat tiga ciri fenomena ini:
1) Filamen actin adalah tipikal struktur tisu otot dan sitoskeleton sel eukariotik.
Boleh melayani anda: 10 ciri lipid yang paling cemerlang2) Pempolimeran dan depolimerisasi adalah proses dinamik yang dikawal selia. Di mana pempolimeran atau pengagregatan monomer actin G-ATP-Mg+2 Ia berlaku di kedua -dua hujungnya. Bahawa proses ini berlaku bergantung pada keadaan medium dan protein pengawalseliaan.
3) Pembentukan rasuk dan reticles, yang membentuk sitoskeleton actin, memberi kekerasan kepada motilitas sel. Ini bergantung kepada protein yang mengambil bahagian dalam pembentukan ikatan silang.
Fungsi
Penguncupan otot
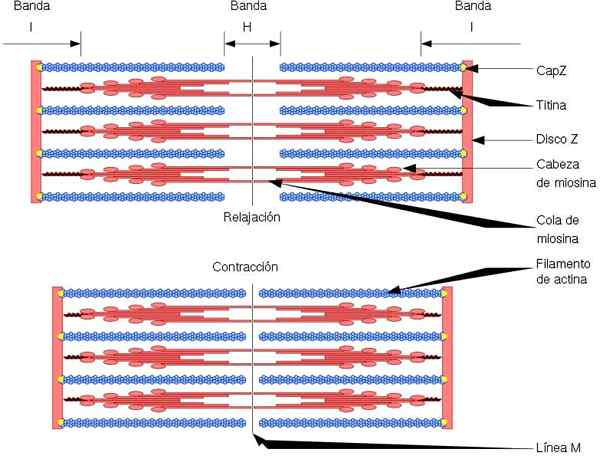
Unit fungsional dan struktur otot rangka adalah sarkomer, yang mempunyai dua jenis filamen: filamen nipis, dibentuk oleh actin, dan filamen tebal, dibentuk oleh myosin. Kedua -dua filamen dianjurkan secara bergantian, dengan cara geometri yang tepat. Benarkan penguncupan otot.
Filamen nipis berlabuh ke kawasan yang disebut cakera z. Rantau ini terdiri daripada rangkaian serat, di mana protein CAPZ terletak, dan yang mana hujung (+) filamen actin berlabuh. Anchor ini menghalang penghapusan akhir (+).
Sebaliknya, di hujung (-) filamen actin, tropomodulin terletak, dan melindungi mereka dari depolymersion. Sebagai tambahan kepada actin, filamen nipis mempunyai tropomiosin dan troponin, yang mempunyai fungsi mengawal interaksi actomiosine.
Bagaimana penguncupan otot berlaku?
Semasa penguncupan otot, filamen tebal membuat pergerakan pivot, dan tarik filamen nipis ke arah tengah sarcomere. Ini menghasilkan gelongsor gentian tebal dan nipis.
Oleh itu, panjang filamen tebal dan nipis tetap malar, tetapi meningkatkan tumpang tindih antara kedua -dua filamen. Panjang sarkomer berkurangan dengan berlabuh filamen nipis ke cakera z.
Bagaimana penguncupan otot berhenti?
ATP adalah mata wang tenaga sel. Oleh itu, ia hampir selalu terdapat dalam tisu otot hidup. Mengambil kira di atas, mesti ada mekanisme yang membolehkan kelonggaran otot dan penangkapan kontraksi.
Dua protein, yang dipanggil tropomiosin dan troponin, mempunyai peranan asas dalam fenomena ini. Ini bekerjasama untuk menyekat tapak kesatuan myosin (dengan itu menghalang kesatuan mereka dengan actin). Akibatnya, otot melegakan.
Sebaliknya, ketika binatang mati mengalami fenomena yang dikenali sebagai Mortis Rigor. Orang yang bertanggungjawab untuk pengerasan badan ini adalah sekatan interaksi antara myosin dan actin, sejurus selepas kematian haiwan itu.
Salah satu akibat dari fenomena ini adalah keperluan untuk ATP untuk pembebasan dua molekul protein. Secara logiknya, tidak ada ketersediaan ATP dalam kain mati dan pelepasan ini tidak dapat berlaku.
Jenis pergerakan lain
Mekanisme yang sama yang kita gambarkan (kemudian kita akan memperdalam mekanisme yang mendasari pergerakan) tidak terhad kepada kontraksi otot haiwan. Dia bertanggungjawab terhadap pergerakan ameboidal yang kita perhatikan di amoebas dan dalam beberapa acuan kolonial.
Dengan cara yang sama, pergerakan sitoplasma yang kita perhatikan dalam alga dan tumbuhan tanah diketuai oleh mekanisme yang sama.
Peraturan pempolimeran dan depolimerisasi filamen actin
Penguncupan tisu dan sel otot licin menghasilkan peningkatan actin f dan penurunan actin g. Polimerisasi actin berlaku dalam tiga peringkat: 1) nukleasi, langkah perlahan; 2) pemanjangan, langkah cepat; dan 3) status stabil. Kelajuan pempolimeran sama dengan kelajuan depolimerisasi.
Boleh melayani anda: Teori fixist: konsep, postulat dan penulisFilamen actin tumbuh lebih cepat pada akhir (+) daripada akhir (-). Kelajuan pemanjangan adalah berkadar dengan kepekatan monomer actin dalam keseimbangan dengan filamen actin, yang dipanggil kepekatan kritikal (CC).
CC untuk akhir (+) adalah 0.1 μm, dan untuk akhir (-) ialah 0.8 μm. Ini bermaksud bahawa 8 kali kurang kepekatan monomer actin diperlukan untuk memolimerisasi akhir (+).
Polimerisasi actin terutamanya dikawal oleh penipuan beta4 (TB4). Protein ini menyatukan actin g dan mengekalkannya, mencegah polimerik. Sementara propylin merangsang pempolimeran actin. Profil mengikat kepada monomer actin yang memudahkan pempolimeran pada akhir (+), dengan pemisahan kompleks actin-tb4.
Faktor lain seperti kenaikan ion (NA+, K+ atau mg+2) memihak kepada pembentukan filamen.
Pembentukan Actin Cytoskeleton
Pembentukan cytoskeleton actin memerlukan penjelasan ikatan silang antara filamen actin. Pautan ini membentuk protein, yang sorotannya adalah: mereka mempunyai domain kesatuan untuk actin; Ramai yang mempunyai domain homolog untuk calponine; dan setiap jenis protein dinyatakan dalam jenis sel tertentu.
Di Philopodes dan Serat Tekanan, ikatan silang antara filamen actin dibuat oleh Fascin dan Philamine. Protein ini, masing -masing, menjadikan filamen actin selari atau mempunyai sudut yang berbeza. Oleh itu, filamen actin menentukan bentuk sel.
Rantau sel dengan jumlah filamen actin yang tertinggi terletak berhampiran membran plasma. Rantau ini dipanggil korteks. Sitoskeleton kortikal dianjurkan dalam bentuk yang berbeza, bergantung kepada jenis sel, dan menghubungkan ke membran plasma melalui penetapan protein.
Beberapa sitoskeleton yang digambarkan adalah sel otot, platelet, sel epitelium dan erythrocytes. Sebagai contoh, dalam sel -sel otot, protein fixative dystrophin menyertai filamen actin ke kompleks glikoprote yang komprehensif membran. Kompleks ini mengikat protein matriks ekstraselular.
Model interaksi actin-miosin
Penyelidik yang dikendalikan oleh Rayment mencadangkan model empat langkah untuk menerangkan interaksi actin dan myosin. Langkah pertama berlaku dengan kesatuan ATP ke kepala myosin. Kesatuan ini menghasilkan perubahan konformasi dalam protein, melepaskannya dari actin dalam filamen kecil.
Kemudian, ATP dihidrolisiskan kepada ADP, melepaskan fosfat bukan organik. Molekul myosin berlabuh ke subunit actin baru, menghasilkan keadaan tenaga yang tinggi.
Pelepasan fosfat bukan organik membawa perubahan dalam myosin, kembali ke penyesuaian awal dan pergerakan filamen kecil, berkenaan dengan filamen tebal, berkenaan dengan filamen tebal. Pergerakan ini menyebabkan pergerakan kedua -dua hujung sarcomer, menghampiri mereka.
Langkah terakhir melibatkan pembebasan ADP. Pada ketika ini kepala myosin adalah percuma dan boleh menyertai molekul ATP baru.
Ia boleh melayani anda: biologi: sejarah, kajian apa, cawangan, pangkalanPergerakan sel didorong oleh pempolimeran actin
Motilitas Rektor adalah jenis motilitas sel. Langkah -langkah jenis motilitas ini adalah: unjuran paksi utama lekatan ke substrat; lekatan kepada substrat; penarikan balik belakang; dan des-perjumpaan.
Unjuran paksi terkemuka memerlukan penyertaan protein, yang mengambil bahagian dalam pempolimeran dan depolimerisasi filamen actin. Paksi terkemuka terletak di korteks sel, yang dipanggil lamellipodio. Langkah -langkah unjuran paksi adalah:
- Pengaktifan reseptor dengan isyarat ekstraselular.
- Pembentukan gtpasas aktif dan phosphoinositol 4.5-bishoposphate (PIP2).
- WASP/SCAR dan ARP2/3 pengaktifan protein, yang mengikat monomer actin untuk membentuk ramuan dalam filamen actin.
- Pertumbuhan pesat filamen actin, pada akhirnya dihiasi dengan myosin, bercabang. Tujahan membran dihasilkan ke hadapan.
- Kemuncak pemanjangan yang dihasilkan oleh protein penutup.
- Hidrolisis ATP dilampirkan pada actin dalam filamen tertua.
- Depolimerisasi actin-ad filamen yang dipromosikan oleh ADF/Cofilina.
- Pertukaran ADP oleh ATP Dipatir oleh Prophylaine, Menjana Actin G-ATP Sedia Memulakan Elongar Racun.
Penyakit yang berkaitan dengan actin
Distrofi otot
Dystrophy otot adalah penyakit degeneratif otot rangka. Ia diwarisi secara beransur -ansur dan dikaitkan dengan kromosom x. Terutamanya mempengaruhi lelaki dengan frekuensi tinggi dalam populasi (satu dalam 3.500 lelaki). Ibu -ibu lelaki ini adalah heterozigot tanpa gejala, dan boleh kekurangan sejarah keluarga.
Terdapat dua bentuk distrofi otot, Duchenne dan Becker, dan kedua -duanya disebabkan oleh kecacatan dalam gen dystrophin. Kecacatan ini terdiri daripada penghapusan yang menghilangkan akson.
Dystrophin adalah protein (427 kDa) yang membentuk ikatan silang antara filamen actin. Ia mempunyai penguasaan kesatuan untuk bertindak dalam terminal N, dan penguasaan kesatuan membran di terminal C. Di antara kedua -dua domain terdapat domain tiub ketiga yang dibentuk oleh 24 pengulangan tandem.
Dalam retikulum kortikal otot, dystrophin mengambil bahagian dalam kesatuan filamen actin ke membran plasma melalui kompleks glikoproteik. Kompleks ini juga mengikat protein matriks ekstraselular.
Pada pesakit yang kekurangan dystrophin berfungsi, dengan distrofi otot Duchenne, sitoskeleton kortikal tidak menyokong membran plasma. Oleh itu, membran plasma rosak oleh tekanan kontraksi otot berulang.
Rujukan
- Devlin, t.M. 2000. Biokimia. Editorial Reverté, Barcelona.
- Gunst, s.J., dan Zhang, w. 2008. Actin sitoskeletal dinamik dalam otot licin: paradigma baru untuk peraturan penguncupan otot licin. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, ms., Baltimore, d., Darnell, J. 2003. Biologi selular dan molekul. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Lehninger-Prinsip Biokimia. W.H. Freeman, New York.
- Pfaendtner, j., Dari salib, dan. M., Voth, g. 2010. Pengubahsuaian Filamen Actin oleh Faktor Depolimerisasi Actin/Cofilin. PNA, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Motiliti selular didorong oleh pemasangan dan pembongkaran actin fillaments. Sel, 112: 453-465.

