Struktur alkohol utama, sifat, nomenclature, contoh

- 3978
- 208
- Ms. Micheal Rippin
A alkohol utama Ia adalah satu di mana kumpulan hidroksil dikaitkan dengan karbon utama; Ini, karbon yang dilampirkan kovalen ke karbon dan hidrogen lain. Formula umumnya ialah ROH, khususnya RCH2Oh, kerana hanya ada satu kumpulan sewa r.
RCH Formula R Group R2Oh boleh jadi sesiapa: rantai, cincin, atau heteroatomes. Ketika datang ke rantai, pendek atau panjang, ia adalah sebelum alkohol utama yang paling mewakili; Antaranya ialah metanol dan etanol, dua yang paling disintesis di peringkat perindustrian.
 Beer Jar: Contoh larutan berair etil alkohol, alkohol utama, dalam matriks organik. Sumber: Engin Akyurt melalui Pexels.
Beer Jar: Contoh larutan berair etil alkohol, alkohol utama, dalam matriks organik. Sumber: Engin Akyurt melalui Pexels. Secara fizikal mereka seperti alkohol lain, dan mata mendidih atau gabungan mereka bergantung pada tahap ramalan mereka; Tetapi secara kimia, mereka adalah yang paling reaktif. Di samping itu, keasidannya lebih tinggi daripada alkohol menengah dan tertiari.
Alkohol utama mengalami reaksi pengoksidaan, menjadi sebilangan besar sebatian organik: ester dan ether, aldehid dan asid karboksilik. Mereka juga boleh mengalami reaksi dehidrasi, menjadi alkena atau olefin.
[TOC]
Struktur alkohol utama
Alkohol utama yang berasal dari alkana linear adalah wakil yang paling. Walau bagaimanapun, pada hakikatnya sebarang struktur, sama ada linear atau bercabang, boleh diklasifikasikan dalam jenis alkohol ini selagi kumpulan OH dikaitkan dengan ch2.
Oleh itu, secara struktural semua orang mempunyai persamaan kehadiran kumpulan -ch2Oh, dipanggil metilol. Ciri -ciri dan akibat dari fakta ini adalah bahawa kumpulan OH kurang dihalang; iaitu, ia dapat berinteraksi dengan persekitaran tanpa atom lain yang menghalang spasial.
Juga, OH yang kurang dihalang bermaksud bahawa atom karbon yang membawanya, pilih2, mungkin mengalami tindak balas pengganti melalui mekanisme SN2 (bimolecular, tanpa pembentukan karbohidrat).
Sebaliknya, OH dengan kebebasan yang lebih besar untuk berinteraksi dengan alam sekitar, diterjemahkan sebagai interaksi intermolecular yang lebih kuat (oleh jambatan hidrogen), yang seterusnya meningkatkan titik gabungan atau mendidih.
Ia boleh melayani anda: nikel hidroksida (iii): struktur, sifat, kegunaan, risikoIa juga berlaku dengan keterlarutannya dalam pelarut kutub, selagi kumpulan r tidak terlalu hidrofobik.
Sifat
Keasidan
Alkohol utama adalah dari semua yang paling berasid. Agar alkohol berkelakuan seperti asid brnsted, ion h mesti menderma+ ke tengah, untuk mengatakan air, menjadi anion alcoxide:
ROH + H2Emas- + H3Sama ada+
Beban negatif merah-, khususnya RCH2Sama ada-, Merasa kurang penolakan pada bahagian elektron dua ikatan C-H, daripada elektron ikatan C-R.
Kumpulan sewa kemudian menjalankan penolakan terbesar, tidak menstabilkan RCH2Sama ada-; Tetapi tidak banyak berbanding dengan hakikat bahawa jika terdapat dua atau tiga kumpulan R, seperti yang berlaku dengan alkohol menengah dan tertiari, masing -masing.
Cara lain untuk menerangkan keasidan alkohol utama adalah melalui perbezaan elektronegativiti, mewujudkan momen dipole: h2Cδ+-Sama adaδ-H. Oksigen menarik ketumpatan elektronik kedua -dua ch2 Sehingga H; Beban separa positif karbon menangkis sedikit hidrogen.
Kumpulan R memindahkan sedikit kepadatan elektroniknya ke Cho2, yang membantu mengurangkan beban separa positifnya dan dengan itu penolakannya untuk beban hidrogen. Semakin banyak kumpulan RA, semakin rendah penolakan, dan oleh itu, trend H akan dikeluarkan sebagai h+.
PKA
Alkohol utama dianggap asid paling lemah daripada air, kecuali metil alkohol, yang sedikit lebih kuat. PKA metil alkohol adalah 15.2; Dan PKA etil alkohol adalah 16.0. Sementara itu, PKA air ialah 15.7.
Walau bagaimanapun, air yang dianggap sebagai asid lemah, seperti alkohol, boleh menyertai H+ Untuk berubah menjadi ion hidrium, h3Sama ada+; iaitu, ia berkelakuan seperti pangkalan.
Dengan cara yang sama, alkohol utama dapat menangkap hidrogen; Terutama dalam beberapa reaksi yang tersendiri, sebagai contoh, dalam transformasi mereka menjadi alkena atau olefines.
Tindak balas kimia
Sewa pembentukan halogenuros
Alkohol bertindak balas dengan halogenida hidrogen untuk menghasilkan halogenida alkil. Kereaktifan alkohol di hadapan halogenida hidrogen, turun mengikut urutan berikut:
Boleh melayani anda: KarbonAlkohol Tersier> Alkohol Menengah> Alkohol Utama
Roh +hx => rx +h2Sama ada
Rx adalah alkil halogenida utama (pilih3CL, ch3Ch2Br, dll.).
Cara lain untuk menyediakan alkil halogenuros adalah melalui reaksi tionilo klorida, reagen sintetik, dengan alkohol utama yang menjadi alkil klorida. Tionilo Chloride (SOCL2) memerlukan bertindak balas kehadiran piridin.
Ch3(Ch2)3Ch2OH +SOCL2 => Ch3(Ch2)3Ch2CL +SO2 + HCl
Reaksi ini sepadan dengan halogenasi 1-penol menjadi 1-clloropentano dengan kehadiran piridin.
Pengoksidaan alkohol utama
Alkohol boleh dioksidakan ke aldehid dan asid karboksilik, bergantung kepada reagen. Pyridinium chlorochromate (PCC) mengoksidakan alkohol utama ke aldehid, menggunakan diklorometana sebagai pelarut (CH2Cl2):
Ch3(Ch2)5Ch2Oh => cho3(Ch2)5Coh
Ini adalah pengoksidaan 1-heptanol dalam 1-heptanal.
Sementara itu, kalium permanganat (KMNO4) Alkohol alkohol terlebih dahulu, dan kemudian teroksida ke aldehida ke asid karboksilik. Apabila kalium permanganat digunakan untuk mengoksidakan alkohol, pemecahan hubungan antara karbon 3 dan 4 harus dielakkan.
Ch3(Ch2)4Ch2Oh => cho3(Ch2)4COOH
Ini adalah pengoksidaan 1-heksanol kepada asid heksanoik.
Dengan kaedah ini, sukar untuk mendapatkan aldehid, kerana ia dengan mudah mengoksidakan asid karboksilik. Keadaan yang sama diperhatikan apabila asid kromik digunakan untuk mengoksidakan alkohol.
Pembentukan E éteres
Alkohol utama boleh menjadi ether apabila dipanaskan dengan kehadiran pemangkin, biasanya asid sulfurik:
2 RCH2Oh => rch2Och2R +h2Sama ada
Pembentukan Esares Organik
Pemeluwapan alkohol dan asid karboksilik, esterifikasi nelayan, yang dikatalisis oleh asid, menghasilkan ester dan air:
Boleh melayani anda: Carbocation: pembentukan, ciri, jenis, kestabilanR'oh +rcooh rcoor ' +h2Sama ada
Reaksi yang terkenal ialah etanol dengan asid asetik, untuk memberikan etil asetat:
Ch3Ch2OH +CH3COOH CH3Coohch2Ch3 + H2Sama ada
Alkohol utama adalah yang paling mudah terdedah kepada tindak balas pensyarah Fischer.
Dehidrasi
Pada suhu tinggi dan dalam medium berasid, biasanya asid sulfurik, alkohol dehidrat menyebabkan alkena dengan kehilangan molekul air.
Ch3Ch2Oh => h2C = ch2 + H2Sama ada
Ini adalah tindak balas dehidrasi etanol kepada etilena. Formula umum yang lebih sesuai untuk tindak balas jenis ini, khususnya untuk alkohol utama, akan menjadi:
Rch2Oh => r = cho2 (Apa yang sama dengan RC = CH2)
Nomenclature
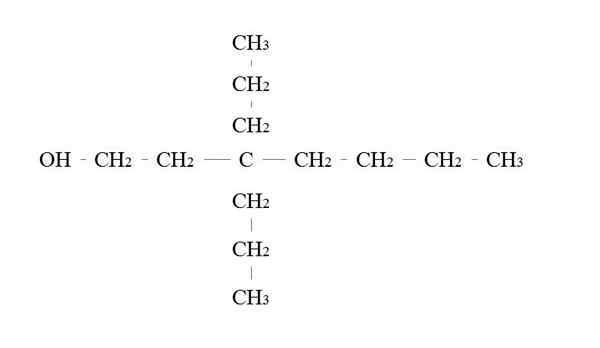 Contoh alkohol utama. Sumber: Gabriel Bolívar.
Contoh alkohol utama. Sumber: Gabriel Bolívar. Peraturan untuk menamakan alkohol utama adalah sama seperti alkohol yang lain; Dengan pengecualian, kadang -kadang tidak perlu untuk menghitung pembawa oh.
Di bahagian atas terdapat rantai utama tujuh -karbon. Karbon dikaitkan dengan OH diberikan bilangan 1, dan kemudian ia mula dikira dari kiri ke kanan. Oleh itu, nama IUPAC adalah: 3.3-dietilheptanol.
Perhatikan bahawa ini adalah contoh alkohol utama yang sangat bercabang.
Contoh
Akhirnya, beberapa alkohol utama disebut mengikut tatanama tradisional dan sistematik mereka:
-Methyl, ch3Oh
-Ethyl, ch3Ch2Oh
-N-propyl, ch3Ch2Ch2Oh
-N-hexyl, ch3Ch2Ch2Ch2Ch2Ch2Oh
Ini berasal dari alkana linear. Contoh lain adalah:
-2-fenyletanol, c6H5Ch2Ch2OH (c6H5 = cincin benzena)
-2-propen-1-oc (Alkohol Allilic), CHO2= Chch2Oh
-1,2-taodiol, ch2Oh2Oh
-2-chloroetanol (ethyleclorhydrin), clch2Ch2Oh
-2-buten-1-ol (Alkohol Crotilic), CH3CH = Chch2Oh
Rujukan
- Morrison, r.T. Dan Boyd, r. N. (1987). Kimia organik. (5TA Edisi). Addison-Wesley Iberoamericana
- Carey, f. Ke. (2008). Kimia organik. (6TA Edisi). McGraw-Hill, Intermerica, Editores s.Ke.
- Sains Mel. (2019). Bagaimana pengoksidaan alkohol utama berlaku. Pulih dari: Melscience.com
- Persatuan Kimia Diraja. (2019). Definisi: alkohol utama. Pulih dari: RSC.org
- Chriss e. McDonald. (2000). Pengoksidaan alkohol utama kepada ester: tiga eksperimen penyiasatan yang berkaitan. J. Chem. Pendidikan., 2000, 77 (6), p 750. Doi: 10.1021/ED077P750

