Affinity Elektronik
- 3943
- 614
- Donnie Ryan
Apakah pertalian elektronik?
The Affinity Elektronik Ia ditakrifkan sebagai jumlah tenaga yang dikeluarkan apabila mol atom dalam keadaan gas digabungkan dengan mol elektron untuk membentuk mole anion, juga dalam keadaan gas. Dalam erti kata lain, ia merujuk kepada negatif variasi entalpi proses berikut:
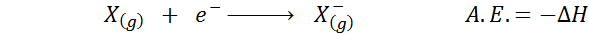
Seperti namanya, pertalian elektronik (a.Dan.) Ini adalah ukuran trend yang mempunyai atom untuk menyertai elektron. Iaitu, ia mengukur pertalian atom untuk elektron.
Tafsiran Affinity Elektronik
Disebabkan cara ia ditakrifkan, pertalian elektronik yang tinggi menunjukkan bahawa variasi entalpi sangat negatif. Ini seterusnya menunjukkan bahawa proses itu sangat baik dan produknya lebih stabil daripada reagen. Atas sebab ini, kita juga boleh mengatakan bahawa pertalian elektronik adalah ukuran tidak langsung kestabilan anion.
Semakin besar pertalian elektronik atom, semakin besar trend untuk membentuk anion. Inilah sebabnya atom -atom seperti klorin, yang pertalian elektroniknya adalah 349 kJ/mol, cenderung membentuk anion dengan mudah (dalam hal ini anion klorida), sementara atom -atom lain seperti magnesium, yang pertalian elektroniknya negatif, tidak membentuk anion.
Penjelasan mengenai pertalian elektronik dan tenaga pengionan
Banyak kali anda berfikir tentang pertalian elektronik sebagai kebalikan dari tenaga pengionan (kecenderungan atom gas untuk kehilangan elektron), tetapi ini tidak begitu. Pertimbangkan, sebagai contoh, atom x.
Ia boleh melayani anda: Tusfrano: struktur kimia, sifat dan kegunaanAffinity elektroniknya merujuk kepada perubahan tenaga proses yang ditunjukkan di atas dalam persamaan pertama. Walau bagaimanapun, tenaga pengionannya merujuk kepada perubahan tenaga apabila atom kehilangan elektron:
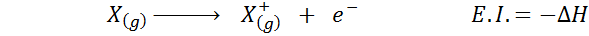
Walaupun reaksi ini nampaknya menjadi tindak balas yang bertentangan dengan sebelumnya.
Apa yang menentukan pertalian elektronik?
Untuk mengetahui ciri -ciri atom yang mempengaruhi nilai pertalian elektroniknya, kestabilan atom asal mesti dipertimbangkan, serta anion yang terbentuk. Sekiranya anion lebih stabil daripada atom, maka pertalian elektronik akan tinggi, jika tidak, ia akan menjadi rendah atau negatif.
Tetapi bagaimana untuk mengetahui yang mana dari dua spesies lebih stabil? Untuk itu, kami bergantung pada dua faktor:
- Konfigurasi Elektronik. Terdapat lebih banyak tetapan elektronik yang stabil daripada yang lain. Secara umum, konfigurasi lapisan penuh (seperti gas mulia) adalah yang paling stabil dari semua. Kemudian diikuti oleh konfigurasi lapisan separa llena, di mana semua orbital lapisan Valencia mempunyai separuh daripada elektron yang mereka dapat (contohnya, 4S14p3).
- Penolakan elektronik. Sekiranya anion beban -1 dibandingkan, dengan anion beban -2, dalam kes kedua akan ada lebih banyak penolakan antara elektron, yang menjejaskan anion.
Kecenderungan Affinity Elektronik Berkala
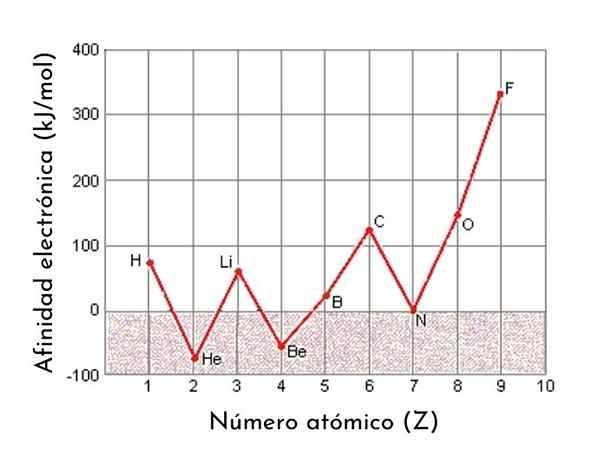
 Graf yang menunjukkan pertalian elektronik dari 9 elemen pertama dalam jadual berkala
Graf yang menunjukkan pertalian elektronik dari 9 elemen pertama dalam jadual berkala Affinity Elektronik adalah salah satu sifat berkala unsur -unsur. Iaitu, ia adalah harta yang berbeza -beza dari satu elemen ke yang lain bergantung pada kedudukannya dalam jadual berkala. Secara umum, pertalian elektronik meningkat apabila saiz atom berkurangan.
Ia boleh melayani anda: formula separuh maju: Apakah dan contoh (metana, propana, butana ...)Dalam pengertian ini, saiz atom berbeza -beza bergantung pada tempoh dan kumpulan di mana ia terletak, jadi pertalian elektroniknya juga berbeza seperti yang dijelaskan di bawah:
Variasi pertalian elektronik dalam tempoh
Sekurang -kurangnya untuk unsur -unsur wakil (yang dimiliki oleh blok S dan P dari jadual berkala), dapat diperhatikan bahawa pertalian elektronik mempunyai kecenderungan umum untuk meningkat dari kiri ke kanan, disebabkan peningkatan beban nuklear yang efektif yang mampu menarik elektron dengan kekuatan yang lebih besar.
Sebagai contoh, jika kita mengambil tempoh ke -3 jadual berkala, kita dapat melihat bahawa pertalian elektronik Li (60 kJ/mol) kurang daripada oksigen (141 kJ/mol) dan ini kurang daripada fluorida (328 kJ /mol).
Pengecualian
Peraturan sebelumnya tidak selalu dipenuhi.
Pertama, apabila bergerak dari logam alkali ke alkaliner, pertalian elektronik berkurangan. Ini kerana untuk logam alkali (konfigurasi elektronik NS1) Adalah baik untuk menangkap elektron, kerana mereka akan selesai mengisi orbit mereka.
Dalam kes alkalineros (konfigurasi elektronik ns2) menangkap elektron tidak menguntungkan kerana mereka sudah mempunyai orbital penuh mereka. Perkara yang sama berlaku apabila bergerak dari halogen (yang mempunyai pertalian elektronik semua elemen) ke gas mulia.
Variasi pertalian elektronik di seluruh kumpulan
Dalam hal kumpulan, tingkah laku bahkan kurang diramalkan. Peraturan umum ialah a.Dan. meningkat dari bawah ke atas, ke arah yang sama yang mengurangkan jejari atom. Untuk logam alkali dan halogen, peraturan ini dipenuhi dengan baik. Walau bagaimanapun, ini tidak berlaku dengan kebanyakan kumpulan lain.
Boleh melayani anda: kobalt hidroksidaContoh pertalian elektronik beberapa elemen wakil
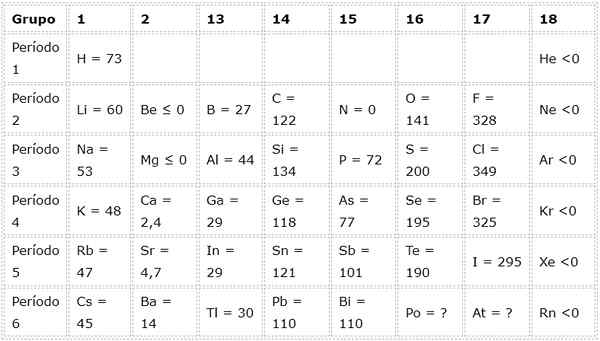
Jadual berikut menunjukkan nilai afiniti elektronik dalam (kJ/mol) dari Unsur -unsur wakil Disusun mengikut kumpulan:
Berikut adalah beberapa contoh pertalian elektronik bersama -sama dengan reaksi yang mereka rujuk:
1. Hidrogen Elektronik Affinity
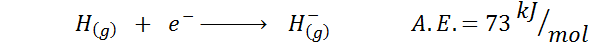
2. Affinity oksigen elektronik
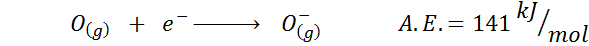
3. Anion Electronic Affinity
Contoh lain yang biasa ialah kes pertalian elektronik anion seperti atau-. A.Dan. Dalam kes ini ia diberikan oleh tenaga yang berkaitan dengan proses berikut:
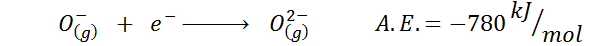
Seperti yang dapat dilihat, pertalian elektronik ini sangat negatif, walaupun ion atau2- Ia mempunyai konfigurasi neon elektronik (gas mulia) dan menjadi ion yang sangat biasa dalam banyak pepejal ionik.
Sebabnya ialah penolakan caj negatif di atau2- Menstabilkan ion keadaan gas ini, tetapi dalam keadaan pepejal, beban stabil oleh kation yang mengelilinginya.

