Prinsip Aufbau

- 1608
- 293
- Erick Krajcik
 Orbital atom mengisi pesanan mengikut prinsip aufbau
Orbital atom mengisi pesanan mengikut prinsip aufbau Apakah prinsip aufbau?
Dia Prinsip Aufbau, Juga dikenali sebagai peraturan hujan atau prinsip pembinaan, ia adalah peraturan praktikal yang membolehkan meramalkan konfigurasi elektronik sebahagian besar unsur -unsur jadual berkala, serta ionnya.
Prinsip ini menetapkan bahawa, sebagai proton ditambah kepada nukleus, satu demi satu untuk berturut -turut membina setiap elemen kimia, elektron juga ditambah berturut -turut ke orbital atom tenaga yang paling sedikit yang tersedia.
Dengan kata lain, Aufbau menegaskan bahawa terdapat perintah tertentu mengikut orbital atom yang boleh diisi. Pesanan ini dijelaskan di bawah.
Perintah mengisi orbital mengikut prinsip aufbau
Perintah di mana orbital atom diisi bergantung pada tahap tenaga mereka. Peraturan keemasan adalah bahawa tahap tenaga ini diisi dari yang paling sedikit ke yang paling besar, seolah -olah ia adalah bangunan di mana pangsapuri harus diisi di lantai terendah untuk mengakses lantai tertinggi.
Dalam pengertian ini, untuk meramalkan susunan pengisian orbital, kita mesti terlebih dahulu tahu bagaimana mereka diperintahkan mengikut tahap tenaga mereka. Di dalam analogi bangunan, ini bermakna mengetahui pangsapuri (orbital) yang ada di setiap lantai.
Grafik berikut menunjukkan tahap tenaga orbital atom pertama yang diperintahkan dari tenaga terendah hingga lebih besar.
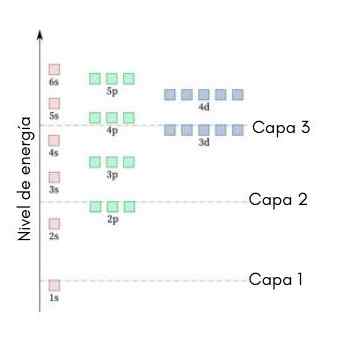
Dalam imej ini, setiap gambar mewakili orbital tertentu di mana hanya 2 elektron sesuai. Setiap kumpulan lukisan warna yang sama mewakili sub -tahap tenaga.
Sub -level ini dikenal pasti dengan nombor dan huruf (1s, 3p, 3d, dll.). Bilangannya menunjukkan tahap tenaga utama, sementara huruf menunjukkan jenis orbital yang membentuk kumpulan.
Ia boleh melayani anda: Aluminium Chloride (ALCL3)Mengikut skim ini, sub -tahap pertama yang mesti diisi adalah 1s (tenaga paling kurang semua), maka datang, 2s, 2p, 3s, 3p, 4s, 3d dan sebagainya.
Peraturan hujan
Walaupun betapa mudahnya untuk menetapkan susunan mengisi jika anda mempunyai graf seperti yang sebelumnya, sukar untuk mengingati urutan tertentu di mana sub -level yang berbeza pergi. Untuk ini, apa yang dipanggil "Peraturan Hujan" digunakan.
Peraturan ini terdiri daripada dua langkah mudah:
Langkah 1
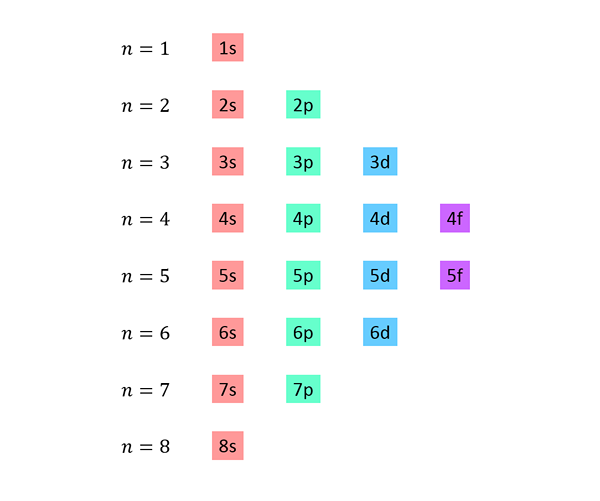
Senarai dibuat di mana setiap baris sepadan dengan tahap tenaga, dan mengandungi satu demi satu, semua sub -level tersedia pada tahap tenaga itu.
Sebagai contoh, baris pertama sepadan dengan tahap 1 (n = 1) dan hanya mengandungi sub -level 1S; Baris kedua sepadan dengan tahap n = 2 dan mengandungi 2s dan 2p sub -level; Yang ketiga mengandungi sub -level 3s, 3p dan 3d, dan sebagainya.
Senarai lengkap kelihatan seperti ini:
Langkah 2
Diagonal menurun diambil dari kanan ke kiri, satu di bawah yang lain, seperti yang ditunjukkan di bawah.
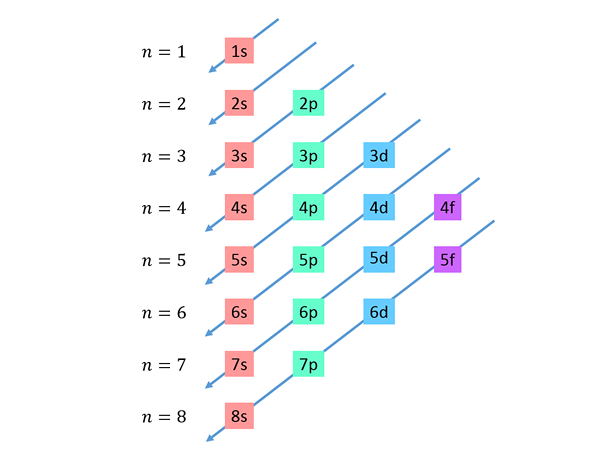
Garis ini menyerupai laluan air yang jatuh semasa angin dengan angin, jadi graf ini biasanya dipanggil "kaedah hujan". Pesanan pengisian ditentukan oleh urutan di mana pepenjuru ini menyentuh sub -level dalam senarai.
Berdasarkan angka sebelumnya, urutan tenaga orbital dan, oleh itu, urutan yang harus diisi adalah:
Boleh melayani anda: Jadual kuantum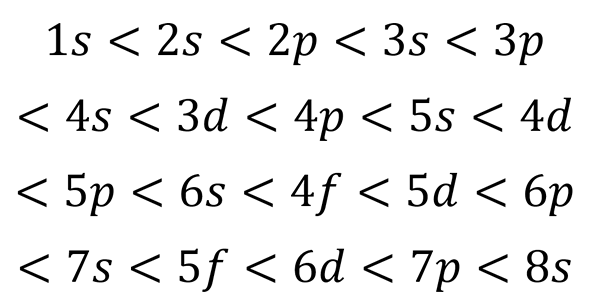
Pesanan pengisian ini adalah satu -satunya yang sangat penting ketika menulis konfigurasi elektronik atom. Semasa mengisi sub -level ini, perlu diingat bahawa dalam sub -level s Hanya 2 elektron yang sesuai p Sesuai 6, di d Mereka sesuai 10 dan di F Mereka sesuai dengan 14.
Pengecualian pada permulaan Aufbau
Prinsip Aufbau dengan jelas menetapkan bahawa sub -tahap tidak dapat diisi sehingga semua sub -level sebelumnya telah diisi sepenuhnya. Walau bagaimanapun, terdapat beberapa pengecualian terhadap peraturan ini.
Dalam beberapa kes, atom lebih suka mempunyai sub -tahap tenaga yang diisi dengan tepat separuh daripada mempunyai yang tidak lengkap yang tidak penuh separuh. Dalam kes tersebut, konfigurasi elektronik sebenar atom tidak sepadan dengan urutan yang diramalkan oleh kaedah hujan.
Sebagai contoh, menurut prinsip Aufbau, atom krom harus mempunyai konfigurasi elektronik yang berakhir pada 4S2 3d4. Walau bagaimanapun, konfigurasi sebenar adalah 4s1 3d5 Oleh itu, sub -level 4s dan 3d dipenuhi separuh manakala dalam konfigurasi lain no.
Perkara yang sama berlaku untuk tembaga yang konfigurasi berakhir pada 4s1 3d10, bukan 4s2 3d9, kerana dengan itu mengisi sub -level D dan S penuh separuh.
Contoh permohonan Prinsip Aufbau
Seterusnya, terdapat 5 contoh elemen yang memenuhi prinsip Aufbau:
Contoh 1: Konfigurasi Elektronik Natrium
Natrium adalah elemen 11, jadi ia mempunyai 11 proton dan 11 elektron. Konfigurasi elektroniknya adalah 1s2 2s2 2 p6 3s1.
Contoh 2: Konfigurasi Elektronik Argon
Argon (AR) adalah elemen 18, jadi ia mempunyai 18 proton dan 18 elektron. Oleh itu, konfigurasi elektroniknya adalah 1s2 2s2 2 p6 3s23p6. Dapat dilihat bahawa sub -level dan sub -levelnya sepenuhnya.
Boleh melayani anda: propylene (c3h6)Contoh 3: Konfigurasi Gallium Elektronik
Gallium (GA) adalah elemen 31, jadi ia mempunyai 31 proton dan 31 elektron. Konfigurasi elektroniknya adalah 1s2 2s2 2 p6 3s23p64s23d104p1.
Ini boleh ditulis dengan ringkasan cara [ar] 4s23d104p1, di mana [AR] mewakili konfigurasi argon elektronik yang dibentangkan dalam contoh sebelumnya.
Contoh 4: Konfigurasi Karbon Elektronik
Karbon (c) adalah elemen 6, jadi ia mempunyai 6 proton dan 6 elektron. Konfigurasi elektroniknya adalah 1s2 2s2 2 p2.
Contoh 5: Konfigurasi Klorin Elektronik
Klorin (cl) adalah elemen 17. 17 elektronnya diedarkan mengikut konfigurasi elektronik berikut: 1s2 2s2 2 p6 3s23p5 atau [ne] 3s23p5.
Contoh tambahan pengecualian pada permulaan Aufbau
Seterusnya, terdapat 2 contoh elemen tambahan yang melanggar prinsip Aufbau:
Contoh 6: Konfigurasi Elektronik Molibdenum
Molybdenum (MO) adalah elemen 42. 36 elektron pertama diedarkan dengan cara yang sama seperti di crypton, tetapi elektron valensnya tidak mengikut urutan biasa. Daripada mempunyai konfigurasi elektronik [kr] 5s24d4, Konfigurasinya ialah [KR] 5S14d5, Sama dengan apa yang berlaku dengan Chrome.
Contoh 7: Konfigurasi Elektronik Perak
La Plata (AG, Elemen 47) membentangkan pelanggaran prinsip Aufbau yang serupa dengan tembaga. Konfigurasi elektroniknya ialah [kr] 5s14d10 Bukan [kr] 5s24d9.

