Peraturan Octet

- 5037
- 126
- Ms. Santos Fritsch
 Perwakilan molekul karbon dioksida yang menunjukkan pematuhan dengan peraturan oktet
Perwakilan molekul karbon dioksida yang menunjukkan pematuhan dengan peraturan oktet Apakah peraturan oktet?
The Peraturan Octet Ini adalah peraturan praktikal yang menerangkan pembentukan ikatan kimia unsur -unsur wakil berdasarkan konfigurasi elektronik lapisan valensinya.
Mengikut peraturan ini, atom -atom menggabungkan satu sama lain sedemikian rupa sehingga setiap atom dikelilingi oleh lapan elektron dalam lapisan valensinya (oleh itu perkataan oktet).
Peraturan ini diterbitkan secara serentak dalam 1.916 Kedua -dua Gilbert Lewis dan Walther Kossel. Ia mencerminkan pemerhatian bahawa gas mulia sangat stabil dan semua, kecuali helium, mereka dicirikan dengan mempunyai lapisan valensi mereka dengan 8 elektron.
Teori ini menetapkan bahawa atom berkongsi atau menukar elektron dengan membentuk ikatan kimia, untuk memperoleh konfigurasi elektronik penuh ini.
Peraturan oktet dan struktur lewis
Peraturan oktet dan struktur Lewis berkait rapat. Ini kerana peraturan oktet adalah salah satu asas untuk memahami pembentukan ikatan kimia, jadi ia membolehkan untuk meramalkan dalam kebanyakan kes, struktur bahan kimia Lewis.
Dalam pengertian ini, salah satu langkah penting untuk menarik struktur Lewis, setelah meletakkan hubungan mudah antara semua atom yang membentuk molekul, adalah untuk mengedarkan elektron valensi yang tinggal di kalangan atom elektronegatif yang paling banyak untuk menyelesaikan oktet mereka.
Dalam kes di mana oktet tanpa mengisi, ikatan berganda atau tiga terbentuk, selalu mencari peraturan oktet untuk sebanyak mungkin atom. Oleh itu, peraturan empirikal ini penting untuk pembinaan struktur Lewis.
Ia boleh melayani anda: perak yoduro (AGI): struktur, sifat, mendapatkan, menggunakanContoh pematuhan dengan peraturan oktet
Peraturan oktet terutamanya digunakan untuk unsur -unsur wakil, iaitu, kepada blok S dan P dari jadual berkala. Peraturan ini secara konsisten digunakan untuk sebatian yang mengandungi karbon, nitrogen, oksigen dan halogen, dan dengan beberapa pengecualian kepada unsur -unsur lain dari blok p. Walau bagaimanapun, kebanyakan logam peralihan tidak mematuhi.
Beberapa contoh sebatian di mana peraturan oktet dipenuhi untuk semua atom adalah:
Karbon dioksida (CO2)
Seperti yang dapat dilihat dalam struktur Lewis karbon dioksida yang dibentangkan di bawah, kedua -dua karbon pusat dan kedua -dua atom oksigen mematuhi peraturan oktet.
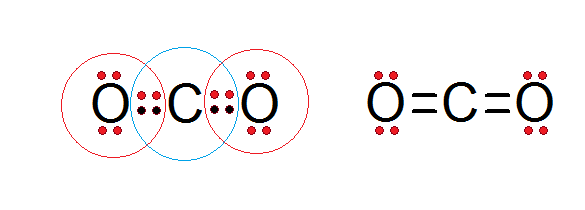
Karbon dikelilingi oleh 4 elektron valensi, ditambah dua elektron dari setiap oksigen, yang menyumbang untuk membentuk ikatan ganda c = o, manakala setiap oksigen dikelilingi oleh 6 elektron sendiri ditambah sepasang dari karbon.
Neopentano (c5H12)
Dalam majoriti sebatian organik, semua atom memenuhi peraturan oktet (kecuali hidrogen yang dikelilingi oleh hanya 2 elektron). Ini termasuk alkana seperti Neopentano atau 2.2-dimetilpropane:
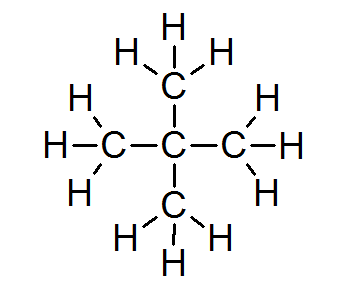
Dalam kes ini, ia juga dapat dilihat bahawa setiap atom karbon berkongsi empat elektronnya dengan 4 atom jiran, masing -masing menyediakan salah satu elektronnya untuk membentuk 4 ikatan kovalen sederhana yang disimpan bersama.
Atas sebab ini, setiap atom karbon dikelilingi oleh 8 elektron valensi, mematuhi peraturan oktet.
Boleh melayani anda: tenaga pengaktifanKarbon monoksida (CO)
Karbon monoksida adalah sebatian molekul lain di mana elektron saham oksigen dan karbon membentuk ikatan kovalen untuk memenuhi peraturan oktet.
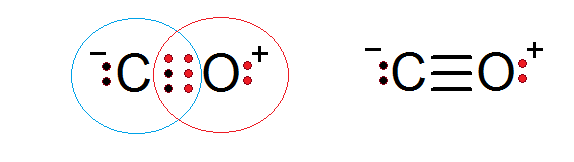
Dalam kes ini, karbon menyediakan dua elektron dan oksigen 4 untuk melengkapkan 6 elektron yang diperlukan untuk membentuk ikatan kovalen tiga yang menyatukannya. Setiap dua atom mempunyai elektron tambahan tanpa berkongsi yang melengkapkan setiap oktet.
Anion nitrat (tidak3-)
Juga dalam hal ion peraturan oktet dipenuhi. Ion nitrat mempunyai atom nitrogen pusat yang dikelilingi oleh 3 atom oksigen.
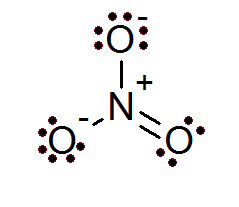
Seperti yang dapat dilihat dalam kes ini, semua atom mempunyai oktet penuh mereka, dua oksigen mempunyai beban formal negatif manakala nitrogen mempunyai beban formal positif, yang mengakibatkan beban bersih -1 nitrat ion.
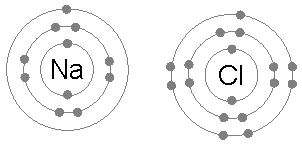
Natrium klorida (NaCl)
Pertukaran elektron untuk membentuk sebatian ionik juga merupakan contoh umum penggunaan peraturan oktet.
Apabila natrium klorida dibentuk dari klorin dan natrium, ia bermula dari dua atom yang tidak mematuhi peraturan oktet, kerana natrium pada elektron dan klorin tidak mempunyai seseorang untuk menyelesaikan oktetnya.
Kemudian, natrium memberikan elektron kepada klorin, meninggalkan kation yang dikelilingi oleh 8 elektron dan seterusnya menyelesaikan oktet ke klorin dengan membentuk ion klorida.
 Pengecualian terhadap peraturan oktet
Pengecualian terhadap peraturan oktet
Sama seperti terdapat sebilangan besar sebatian di mana semua atom memenuhi peraturan oktet, terdapat juga banyak contoh atom yang tidak mematuhinya.
Ia boleh melayani anda: potensi z: nilai, darjah pembekuan, penentuan, kegunaanAda yang dikelilingi oleh kurang daripada 8 elektron, jadi mereka spesies elektron yang lemah, manakala yang lain dikelilingi oleh lebih daripada lapan elektron, dalam hal ini dikatakan bahawa ia mempunyai oktet yang diperluas atau dipanggil Atom hipervalen.
Contoh spesies elektron miskin
Bordean (bh3)
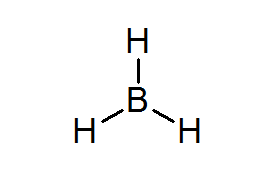
Kompaun ini adalah contoh biasa dari jenis elektron yang lemah. Boron atau hidrogen sekitarnya, mempunyai elektron yang cukup untuk memenuhi peraturan oktet di atom tengah. Ini menyebabkan boron menerima beberapa elektron dari atom lain dalam molekul lain, menjadikan Bordeal menjadi asid dari Lewis.
Aluminium Triclurur (ALCL3)
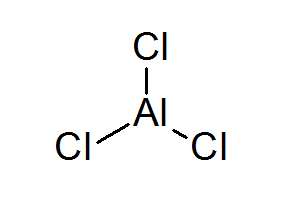
ALCL3 Ini adalah satu lagi contoh asid Lewis yang berhutang tingkah laku kimianya yang tidak memenuhi peraturan oktet.
Contoh spesies hipervaluen
Sulfur Hexafluoruro (SF6)
Contoh khas oktet yang diperluas ialah SF6, yang biasanya diwakili sebagai sulfur pusat dengan 6 ikatan kovalen sederhana dengan atom fluorin. Dalam kes ini, sulfur dikelilingi oleh 12 elektron valensi dan bukannya 8, jadi ia melanggar peraturan oktet.
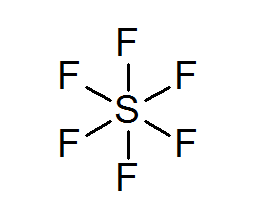
Walaupun begitu, model telah dicadangkan di mana sulfur sebenarnya dikaitkan dengan ikatan kovalen kepada 4 fluors pada masa yang sama, manakala dengan dua yang lain, bentuk ikatan ionik. Jika ya, ia akan memenuhi peraturan oktet.
Fosforus pentachloride (PCL5)
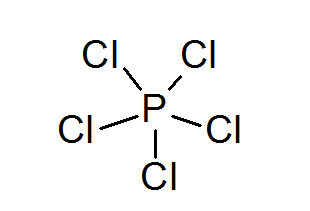
Seperti dalam kes sulfur, fosforus juga boleh membentuk sebatian dengan oktet yang diperluaskan, dalam kes ini dikelilingi oleh 10 elektron.

