Struktur Anisol, Hartanah, Nomenclature, Risiko dan Kegunaan
- 2071
- 343
- Ismael Turner
Dia anisol atau metoxibenzene Ia adalah sebatian organik yang terdiri daripada eter aromatik yang formula kimianya adalah c6H5Och3. Keadaan fizikalnya adalah cecair tanpa warna, yang dapat memberikan pewarnaan kuning. Ia mudah diiktiraf oleh bau anisinya.
Ia kemudiannya adalah sebatian yang tidak menentu dan kuasa perpaduan yang tidak tinggi; Ciri -ciri biasa dalam Ethers Cahaya, yang disimpan dalam bekas tertutup kecil. Khususnya, anisol adalah yang paling mudah dari alkil auril eter; iaitu, mereka yang mempunyai komponen aromatik (AR) dan alkil (R), AR-O-R lain.
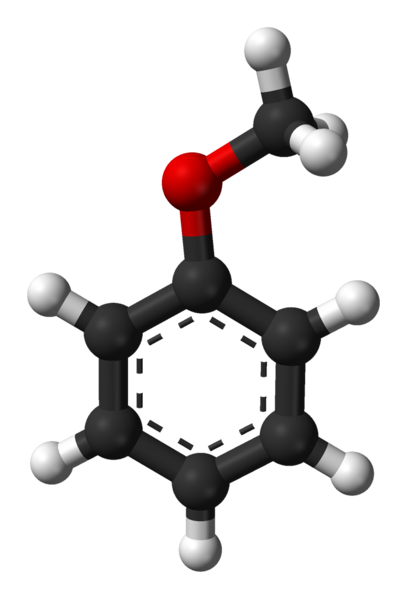
 Molekul anisol. Sumber: Ben Mills melalui Wikipedia.
Molekul anisol. Sumber: Ben Mills melalui Wikipedia. Kumpulan c6H5- datang untuk menunjukkan AR, dan -ch3 A r, dengan itu mempunyai c6H5-O-CH3. Cincin aromatik, dan kehadiran -och3 Sebagai kumpulan substituen yang dipanggil Metoxi, anisol memberikan nukleofiliti yang lebih tinggi daripada benzena dan nitrobenzene. Oleh itu, ia berfungsi sebagai molekul perantara untuk sintesis sebatian dengan aktiviti farmakologi.
Ciri -ciri bau anise telah digunakan untuk menambah anisol kepada produk kosmetik dan kebersihan yang menuntut wangian yang menyenangkan.
[TOC]
Struktur Anisol
Di bahagian atas, struktur molekul anisol ditunjukkan melalui model sfera dan bar. Cincin aromatik dihargai, yang karbonnya adalah sp2 dan oleh itu ia rata, sebagai lembaran heksagon; Dan dikaitkan dengannya, adalah kumpulan metoxi, yang karbonnya adalah SP3, dan hidrogennya berada di atas atau di bawah satah cincin.
Kepentingan kumpulan3 Dalam struktur ia melampaui pemecahan dengan geometri rata molekul: ia memberikan polaritas, dan akibatnya, molekul apolar benzena memperoleh momen dipole tetap.
Momen dipolar
Momen dipole ini disebabkan oleh atom oksigen, yang menarik kepadatan elektronik kedua -dua cincin aromatik dan metil. Terima kasih kepada ini, molekul Anisol boleh berinteraksi dengan pasukan separuh dipolo; Walaupun, ia tidak mempunyai kemungkinan untuk membentuk jambatan hidrogen, kerana ia adalah eter (ROR tidak mempunyai oksigen dikaitkan).
Boleh melayani anda: natrium klorida (NaCl)Titik mendidih yang tinggi (154ºC), secara eksperimen mengesahkan interaksi intermolecular yang kuat yang mengawal cecairnya. Begitu juga, daya penyebaran London hadir, bergantung kepada jisim molekul, dan interaksi π -π antara cincin itu sendiri.
Kristal
Walau bagaimanapun, struktur Anisol tidak membenarkannya.F = -37ºC). Ini juga disebabkan oleh hakikat bahawa apabila jarak intermolecular dikurangkan, penolakan elektrostatik antara cincin aromatik jiran sangat kuat.
Oleh itu, dan menurut kajian kristalografi, molekul anisol dalam kristal pada suhu -173ºC tidak dapat dipesan sedemikian rupa sehingga cincin mereka dihadapi; iaitu, pusat aromatiknya tidak sejajar dengan satu sama lain, tetapi satu kumpulan3 Ia naik atau di bawah cincin jiran.
Sifat
Penampilan fizikal
Cecair tanpa warna tetapi yang boleh membentangkan nada jerami yang berwarna ringan.
Bau
Ia berbau sedikit serupa dengan biji anise.
Rasa
Manis; Walau bagaimanapun, ia agak beracun, jadi ujian ini berbahaya.
Jisim molekul
108,140 g/mol.
Ketumpatan
0.995 g/ml.
Ketumpatan wap
3.72 (dalam hubungan udara = 1).
Takat lebur
-37ºC.
Takat didih
154ºC.
titik pencucuhan
125ºC (cawan terbuka).
Suhu sendiri
475ºC.
Goo
0.778 cp pada 30ºC.
Ketegangan permukaan
34.15 DINS/CM A 30ºC.
Pembiasan indica
1,5179 hingga 20ºC.
Kelarutan
Tidak larut dalam air (sekitar 1mg/ml). Dalam pelarut lain, seperti aseton, ether dan alkohol, namun sangat larut.
Nukleofiliti
Cincin aromatik anisol kaya dengan elektron. Ini kerana oksigen, walaupun menjadi atom yang sangat elektronegatif, menyumbang dengan elektron awan π mereka untuk menghancurkannya melalui cincin dalam pelbagai struktur resonans. Akibatnya, lebih banyak elektron mengembara sistem aromatik dan oleh itu meningkatkan nukleofilinya.
Ia boleh melayani anda: Alkohol Campuran: Struktur, Formula, Hartanah dan KegunaanSecara eksperimen peningkatan nukleofiliti telah ditunjukkan dengan membandingkan kereaktifannya, dalam menghadapi penggantian elektrofili aromatik, dengan benzena. Oleh itu, kesan yang luar biasa dari kumpulan yang dibuktikan3 Mengenai sifat kimia kompaun.
Ia juga harus diperhatikan bahawa penggantian elektrofilik berlaku di kedudukan bersebelahan (-orto) dan bertentangan (untuk) kepada kumpulan metoxi; iaitu, ini adalah pengarah ortho-untuk.
Reaktiviti
Nukleofiliti cincin aromatik Anisol sudah membolehkan anda melihat bagaimana kereaktifinya. Penggantian boleh berlaku sama ada di dalam cincin (disukai oleh nukleofilinya), atau dalam kumpulan metaxi yang sama; Pada yang terakhir pautan O-Ch dipecahkan3 Untuk menggantikan -ch3 oleh kumpulan alqilic yang lain: O-Alquilación.
Oleh itu, dalam proses alkilasi, anisol boleh menerima kumpulan r (serpihan molekul lain) menggantikan H dari cincinnya (c-hidup), atau menggantikan ch3 Dari kumpulan metoxi anda. Imej berikut menggambarkan apa yang baru saja dikatakan:
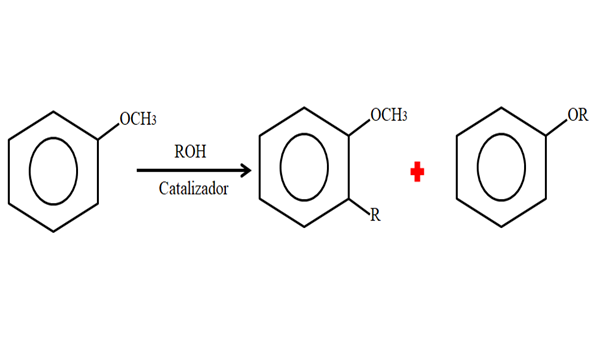 Anisol Alkylation. Sumber: Gabriel Bolívar.
Anisol Alkylation. Sumber: Gabriel Bolívar. Dalam imej kumpulan r terletak di kedudukan -orto, tetapi ia juga boleh berada di kedudukan -untuk, bertentangan dengan -och3. Apabila O -alquilación berlaku, eter baru dengan kumpulan lain -atau diperoleh.
Nomenclature
Nama 'anisol' adalah yang paling terkenal dan diterima, kemungkinan besar berasal dari bau yang serupa dengan anise. Walau bagaimanapun, nama 'metoxibenzene' agak spesifik, kerana ia menetapkan apabila struktur dan identiti eter aromatik ini; Ini adalah nama yang ditadbir oleh tatanama sistematik.
Nama lain yang kurang digunakan, tetapi sama sah, adalah 'fenil metil eter', yang ditadbir oleh tatanama tradisional. Ini mungkin nama yang paling spesifik, kerana ia secara langsung menunjukkan yang merupakan dua bahagian struktur eter: phoenyl-o-metil, c6H5-O-CH3.
Risiko
Kajian perubatan belum dapat menunjukkan kemungkinan kesan fana anisol pada badan pada dos yang rendah. Walau bagaimanapun, seperti hampir semua bahan kimia, ia menghasilkan kerengsaan apabila terlalu banyak masa terdedah dan dalam kepekatan sederhana pada kulit, tekak, paru -paru dan mata.
Boleh melayani anda: Undang -undang Amagat: Penjelasan, Contoh, LatihanJuga, disebabkan oleh nukleofiliti cincinnya, sebahagian daripadanya dimetabolisme dan oleh itu boleh dibiodegrasikan. Sebenarnya, sebagai hasil daripada harta ini, simulasi menunjukkan bahawa ia gagal menumpukan perhatian kepada ekosistem berair sejak organismanya mula merendahkannya; Dan oleh itu, sungai, tasik atau laut boleh mengumpul anisol.
Di dalam tanah, memandangkan turun naiknya, ia menguap dengan cepat dan diseret oleh arus udara; Oleh itu, tidak juga sayur -sayuran atau ladang -ladang yang banyak mempengaruhi.
Sebaliknya, atmosfera ia bertindak balas dengan radikal bebas, dan oleh itu tidak mewakili risiko pencemaran udara kita bernafas.
Aplikasi
Sintesis organik
Dari anisol derivatif lain boleh diperolehi oleh penggantian elektrofilik aromatik. Ini memungkinkan untuk digunakan sebagai perantara untuk sintesis dadah, racun perosak dan pelarut, yang ingin menambah ciri -ciri mereka. Laluan sintetik boleh terdiri daripada kebanyakan.
Wangian
Sebagai tambahan kepada penggunaannya untuk sintesis organik, ia boleh digunakan secara langsung sebagai bahan tambahan untuk krim, salap dan minyak wangi, menggabungkan anti -wangian ke dalam produk tersebut.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. Ke. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Anisole. Pangkalan Data Pubchem, CID = 7519. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Anisole. Diperoleh dari: dalam.Wikipedia.org
- Pereira, Cynthia C. M., De la cruz, marcus h. C., & Lachter, Elizabeth r. (2010). Phaselation cecair anisol dan phenol yang dipangkin oleh niobium fosfat. Jurnal Persatuan Kimia Brazil, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W. dan Goddard R. (2015). Anisole pada 100 K: Penentuan Struktur Kristal Pertama. Crystallogr C Struct Chem Act. Aug; 71 (pt 8): 664-6. Doi: 10.1107/S2053229615012553
- Perumusan kimia. (2018). Metoxibenzene. Pulih dari: formulasi quimica.com

