Latihan kation, perbezaan dengan anion dan contoh

- 2639
- 813
- Horace Gulgowski
A kation Ia adalah spesies kimia yang mempunyai caj positif. Dua jenis ion sedia ada adalah untuk anion. Bebannya adalah hasil kekurangan elektron dalam atom, yang menyebabkan proton teras untuk menjalankan tarikan yang lebih besar. Bagi setiap elektron yang kehilangan atom neutral, beban positif meningkat dalam satu unit.
Jika atom kehilangan elektron, dan oleh itu, bilangan proton lebih besar daripada satu, maka beban positifnya akan menjadi +1; Sekiranya anda kehilangan dua elektron, beban akan menjadi +2, dan sebagainya. Apabila kation mempunyai beban +1, dikatakan sebagai monovalen; Sebaliknya, jika beban dikatakan lebih besar daripada +1, dikatakan bahawa kation adalah serba boleh.
 Hydronio Ion, salah satu kation yang paling mudah. Sumber: Gabriel Bolívar.
Hydronio Ion, salah satu kation yang paling mudah. Sumber: Gabriel Bolívar. Di bahagian atas imej ia ditunjukkan kepada kation h3Sama ada+, Dipanggil Hydronio ion. Seperti yang dapat dilihat, ia hampir tidak mempunyai beban +1, mengikut kation monovalen.
Kation adalah spesies penting, kerana mereka menggunakan daya elektrostatik dengan persekitaran dan molekul mereka. Mereka mempunyai interaksi yang tinggi dengan air, cecair yang menghidrat dan mengangkut mereka ke tanah basah, dan kemudian mencapai akar tumbuhan dan digunakan untuk fungsi fisiologi mereka.
[TOC]
Bagaimana kation terbentuk?
Disebutkan bahawa apabila atom kehilangan elektron, bilangan proton terbesarnya, berhubung dengan elektron, menghasilkan daya tarikan yang diterjemahkan ke dalam beban positif. Tetapi bagaimana kehilangan elektron berlaku? Jawapannya bergantung pada transformasi yang berlaku dalam tindak balas kimia.
Harus diperhatikan bahawa kehadiran atom dengan beban positif tidak semestinya membayangkan pembentukan kation. Supaya ia dapat dipertimbangkan seperti itu, tidak sepatutnya menjadi atom dengan beban formal negatif yang meneutralkan. Jika tidak, akan ada daya tarikan dan penolakan dalam sebatian yang sama dan akan menjadi neutral.
Boleh melayani anda: kalsium sulfat (case4): struktur kimia, sifat, kegunaanCaj rasmi dan lebih banyak pautan
Atom elektronegatif menarik elektron ikatan kovalen mereka ke arah mereka. Walaupun elektron dikongsi sama, terdapat satu titik di mana mereka akan sebahagiannya mempunyai kurang elektron daripada dalam konfigurasi basal mereka; Ini, iaitu atom bebas mereka tanpa dikaitkan dengan elemen lain.
Kemudian, atom -atom elektronegatif ini akan mula mengalami kekurangan elektron, dan dengan itu, proton nukleus mereka akan memberi daya tarikan yang lebih besar; Beban rasmi positif dilahirkan. Sekiranya terdapat hanya beban formal yang positif, kompaun itu akan menunjukkan beban ionik positif global; Oleh itu, kation dilahirkan.
Atom oksigen kation h3Sama ada+ Ini adalah contoh yang setia di atas. Dengan mempunyai tiga ikatan O-H, satu lebih daripada dalam molekul air (H-O-H), mengalami kehilangan elektron berkenaan dengan keadaan basalnya. Pengiraan beban rasmi membolehkan menentukan bila ini berlaku.
Sekiranya pembentukan O-H yang lain diandaikan untuk satu ketika, kation divalen akan diperolehi4Sama ada2+. Perhatikan bahawa beban divalen di atas kation ditulis seperti berikut: Nombor diikuti simbol '+'; Dengan cara yang sama, anion diteruskan.
Pengoksidaan
Logam adalah formator kation. Walau bagaimanapun, tidak semua orang boleh membentuk ikatan kovalen (atau sekurang -kurangnya kovalen semata -mata). Sebaliknya, mereka kehilangan elektron untuk menubuhkan ikatan ionik: beban positif menarik negatif, bersatu dengan kekuatan fizikal.
Oleh itu, logam kehilangan elektron untuk bergerak dari m ke mn+, di mana n Ia biasanya sama dengan bilangan kumpulan anda dalam jadual berkala; Walaupun n Anda boleh mengambil beberapa nilai keseluruhan, yang berlaku terutamanya dengan logam peralihan. Kehilangan elektron ini dijalankan dalam jenis tindak balas kimia yang disebut pengoksidaan.
Boleh melayani anda: Alkohol Tersier: Struktur, sifat, contohLogam mengoksidakan, kehilangan elektron, bilangan proton atom mereka melebihi elektron, dan akibatnya mempamerkan beban positif. Kerana ada pengoksidaan, mesti ada ejen pengoksidaan, yang mengurangkan atau keuntungan elektron yang hilang oleh logam. Oksigen adalah ejen pengoksidaan yang paling terkenal dari semua.
Perbezaan dengan anion
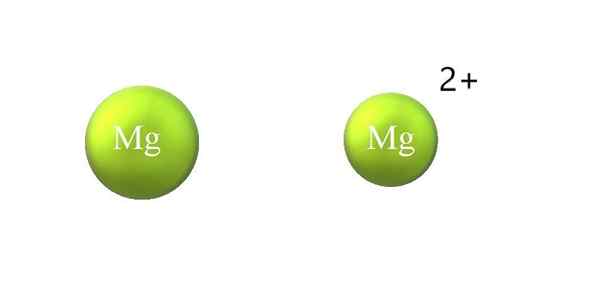 Penguncupan jejari atom dalam kation. Sumber: Gabriel Bolívar.
Penguncupan jejari atom dalam kation. Sumber: Gabriel Bolívar. Berikut adalah perbezaan antara kation dan anion:
-Kation umum lebih kecil daripada anion. Imej atas menunjukkan bagaimana jejari atom mg dikurangkan dengan kehilangan dua elektron dan menjadi mg kation2+; Sebaliknya berlaku dengan anion: mereka menjadi lebih besar.
-Ia mempunyai lebih banyak proton daripada elektron, sementara anion mempunyai lebih banyak elektron daripada proton.
-Menjadi lebih kecil, ketumpatan bebannya lebih tinggi, dan oleh itu mempunyai kuasa polarisasi yang lebih besar; iaitu, ubah bentuk awan elektronik atom jiran.
-Kation bergerak ke arah yang sama seperti medan elektrik yang digunakan, sementara anion melakukannya ke arah yang bertentangan.
Contoh kation yang paling biasa
Monoatomic
Kation monoatomik kebanyakannya dari logam (kecuali pengecualian tertentu, seperti h+). Selebihnya, sangat jarang untuk mempertimbangkan kation yang diperolehi dari elemen bukan logam.
Ia akan dilihat bahawa banyak daripada mereka adalah di atau serba boleh, dan bahawa magnitud beban mereka bersetuju dengan bilangan kumpulan mereka dalam jadual berkala.
Ia boleh melayani anda: Ribulosa-1,5-biphosphate (RUBP): Ciri-ciri, Karbolixation-Li+
-Na+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Semua mempunyai persamaan beban '1+', yang ditulis tanpa meletakkan nombor, dan juga berasal dari Kumpulan 1: Logam Alkali. Selain itu, terdapat kation ag+, Salah satu logam peralihan yang paling biasa.
-Menjadi2+
-Mg2+
-Ac2+
-Encik2+
-Ba2+
-Ra2+
Kation divalen ini berasal dari logam masing -masing milik Kumpulan 2: Logam Alkalinerior.
-Kepada3+
-Ga3+
-Dalam3+
-Tl3+
-NH3+
Kation trivalen kumpulan boro.
Setakat ini contohnya dicirikan dengan mempunyai valensi atau pemuatan tunggal. Kation lain mempamerkan lebih daripada satu keadaan valensi atau pengoksidaan positif:
-Sn2+
-Sn4+ (timah)
-Co2+
-Co3+ (kobalt)
-Au+
-Au3+ (Emas)
-Iman2+
-Iman3+ (Besi)
Dan logam lain, seperti mangan, masih boleh mempunyai lebih banyak valensi:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Semakin besar beban, lebih kecil dan polarisasi akan menjadi kation.
Polyiatomic
Tanpa pergi ke kimia organik, terdapat kation bukan organik dan polylamical yang sangat biasa dalam kehidupan seharian; seperti:
-H3Sama ada+ (Hydronio, sudah disebutkan).
-NH4+ (ammonium).
-Tidak2+ (Nitronio, hadir dalam proses nitrasi).
-Ph4+ (Phosphonium).
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Helmestine, Anne Marie, Ph.D. (5 Mei 2019). Definisi dan Contoh Kation. Pulih dari: Thoughtco.com
- Wyman Elizabeth. (2019). Kation: Definisi & Contoh. Kajian. Pulih dari: belajar.com
- Dummies. (2019). Ins positif dan negatif: kation dan anion. Pulih dari: patung.com
- Wikipedia. (2019). Kation. Pulih dari: Adakah.Wikipedia.org
- « Struktur Anisol, Hartanah, Nomenclature, Risiko dan Kegunaan
- Asal Arkeolitik, Ciri, Iklim, Flora dan Fauna »

