Sejarah Antimon, Struktur, Sifat, Kegunaan dan Risiko

- 2513
- 279
- Dallas Bernhard
Dia antimoni Ia adalah metalloid perak yang berkilau, dan dengan warna biru tertentu. Pepejalnya juga dicirikan dengan menjadi sangat rapuh dan tekstur squamous. Ia tergolong dalam kumpulan 15 jadual berkala, yang diketuai oleh nitrogen. Selepas bismut (dan Moscowium), ia adalah elemen paling berat dari kumpulan.
Ia diwakili oleh simbol kimia sb. Secara semulajadi ia didapati terutamanya dalam mineral Stabit dan Ullmannite, yang formulas kimianya adalah SB2S3 dan NISB, masing -masing. Kecenderungan yang tinggi untuk membentuk sulfida dan bukan oksida adalah kerana ia lembut secara kimia.
 Antimoni kristal. Sumber: SCI-FATCS Terbaik [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Antimoni kristal. Sumber: SCI-FATCS Terbaik [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Sebaliknya, antimoni juga lembut secara fizikal, menyampaikan kekerasan 3 pada skala Mohs. Ia stabil pada suhu bilik dan tidak bertindak balas dengan oksigen udara. Tetapi apabila dipanaskan dengan kehadiran oksigen, dia membentuk antimoni trioksida, SB2Sama ada3.
Ia juga tahan terhadap tindakan asid lemah; Tetapi panas diserang oleh asid nitrik dan hidroklorik.
Antimoni mempunyai banyak aplikasi, di antaranya digunakan dalam aloi dengan plumbum dan timah, dalam pembuatan bateri untuk kenderaan, bahan geseran yang rendah, dll.
Metalloid ini mempunyai yang jarang dimiliki untuk meningkatkan jumlah apabila dikuatkan, yang membolehkan aloi untuk sepenuhnya menduduki ruang yang digunakan untuk membentuk instrumen yang dikehendaki untuk menghasilkan.
[TOC]
Sejarah Penemuan Anda
BC
Terdapat bukti bahawa dari 3100 hingga.C, antimoni sulfida digunakan sebagai kosmetik di Mesir. Di Mesopotamia, Iraq semasa, sisa vas dan artifak lain didapati bahawa didakwa berkencan antara 3000 dan 2200 tahun hingga.C, di mana ia digunakan dalam penjelasan antimoninya.
Pengenalan istilah
Roman Erúdito Plinio El Viejo (23-79 d.c) menggambarkan penggunaan antimoni, yang dipanggilnya ESTIBIO, dalam penjelasan tujuh ubat dalam perjanjian sejarahnya. Alchemist Abu Mussa Jahir ibn Hayyan (721-815) dikaitkan dengan pengenalan istilah antimoni untuk melantik elemen.
Dia menggunakan etimologi berikut: 'anti' sebagai sinonim untuk penafian, dan 'mono' hanya untuk. Kemudian dia ingin menekankan bahawa antimoni tidak bersendirian. Sudah diketahui bahawa ia adalah sebahagian daripada mineral sulfur, yang seperti elemen lain.
Memperoleh
Naturist Yunani Pedanius Diascorides dipercayai mendapat antimoni tulen, dengan pemanasan antimoni sulfida di aliran udara. Vannocio Biringucio metalurgi Itali, dalam Kitab Piroteknik (1540), membuat penerangan tentang kaedah untuk mengasingkan antimoni.
Ahli kimia Jerman Andreas Libavius (1615), melalui penggunaan campuran besi, antimoni sulfida, garam dan kalium tartrato, mencapai pengeluaran antimoni kristal.
Laporan terperinci pertama mengenai antimoni dibuat pada tahun 1707 oleh ahli kimia Perancis Nicolas Lemery (1645-1715), dalam bukunya yang dirawat di antimoni.
Boleh melayani anda: tembaga klorida (i) (cucl): struktur, sifat, kegunaanStruktur antimoni
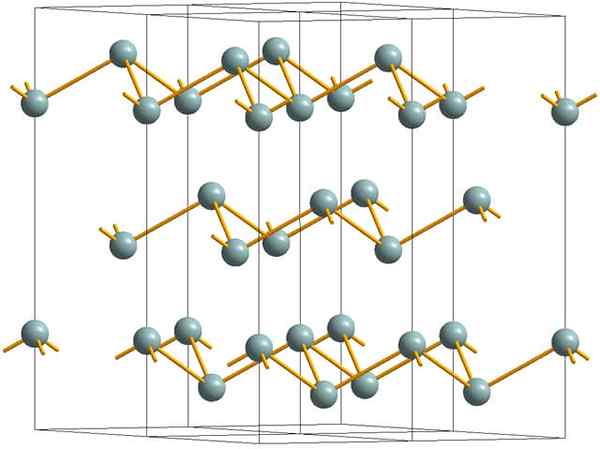 Lapisan berkedut yang membentuk struktur kristal antimoni logam atau perak. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Lapisan berkedut yang membentuk struktur kristal antimoni logam atau perak. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Imej atas menunjukkan struktur lapisan berkerut yang diterima pakai oleh atom arsenik. Walau bagaimanapun, antimoni kelabu, lebih dikenali sebagai antimoni logam, juga mengamalkan struktur ini. Dikatakan bahawa ia "berkedut" kerana terdapat atom SB yang naik dan jatuh dari satah yang terdiri daripada lapisan.
Lapisan -lapisan ini, walaupun mereka bertanggungjawab untuk foton yang berinteraksi dengannya untuk bersinar berkilau perak, menjadikan antimoni sebagai logam, kebenarannya adalah bahawa kekuatan yang menyatukan mereka lemah; Dari sini ke serpihan logam yang jelas SB dapat dengan mudah ditunjukkan dan rapuh atau kasut.
Di samping itu, atom SB dalam lapisan berkedut tidak mencukupi untuk mengumpulkan orbital atom mereka dan dengan itu membuat band yang membolehkan pengaliran elektrik.
Melihat sfera kelabu secara individu, anda dapat melihat bahawa ia mempunyai tiga pautan SB-SB. Dari satah yang lebih tinggi, SB dapat dilihat di tengah segitiga, dengan tiga SB terletak di simpangnya. Walau bagaimanapun, segitiga tidak rata dan mempunyai dua peringkat atau lantai.
Pembiakan sisi segitiga dan pautan mereka menetapkan lapisan berkedut, yang diselaraskan untuk membentuk kristal rhomboébic.
Allotropy
Struktur yang baru diterangkan sepadan dengan antimoni kelabu, yang paling stabil dari empat alotropnya. Tiga lagi alotropes (hitam, kuning, dan letupan) adalah metastable; iaitu, mereka mungkin wujud dalam keadaan yang sangat ketat.
Tidak ada terlalu banyak maklumat mengenai strukturnya. Walau bagaimanapun, diketahui bahawa antimoni hitam adalah amorf, sehingga strukturnya berantakan dan rumit.
Antimoni kuning stabil di bawah -90ºC, ia berkelakuan sebagai elemen bukan logam, dan boleh diramal yang terdiri daripada aglomerat SB kecil4 (sama dengan fosforus); Apabila dipanaskan ia berubah menjadi alotrope hitam.
Dan berkenaan dengan antimoni letupan, ia terdiri daripada tangki gelatin yang dibentuk pada katod semasa elektrolisis penyelesaian berair dari halida antimoni.
Hingga sedikit gosok kuat.
Sifat
Berat atom
121.76 g/mol.
Nombor atom
51.
Konfigurasi Elektronik
[KR] 4D105s25 p3.
Keadaan pengoksidaan
-3, -2, -1, +1, +2, +3, +4, +5.
Penerangan fizikal
Perak yang berkilau, rapuh, permukaan squamous, dengan warna biru. Ia juga boleh muncul sebagai habuk hitam.
Takat lebur
630.63 ºC.
Takat didih
1.635 ºC.
Ketumpatan
-6,697 g/cm3 pada suhu bilik.
-6.53 g/cm3 Dalam keadaan cair, suhu sama dengan atau lebih besar ke titik lebur.
Haba Fusion
19.79 kJ/mol.
Haba pengewapan
193.43 kJ/mol.
Boleh melayani anda: tembaga sulfida: struktur, sifat, kegunaanKapasiti kalori molar
25.23 J/mol.K
Elektronegativiti
2.05 (skala Pauling).
Radio atom
140 malam.
Kekerasan
Ia adalah elemen lembut, dengan kekerasan 3 pada skala Mohs dan boleh tercalar dengan kaca.
Kestabilan
Ia stabil pada suhu bilik, tidak mengalami pengoksidaan. Ia juga tahan terhadap serangan asid.
Isotop
Ia mempunyai dua isotop stabil: 121Sb dan 123Sb. Di samping itu, terdapat 35 isotop radioaktif. Isotop radioaktif 125SB adalah yang mempunyai separuh hayat terbesar: 2.75 tahun. Secara umum, isotop radioaktif memancarkan sinaran β+ dan β-.
Kekonduksian elektrik dan terma
Antimoni adalah konduktor panas dan elektrik yang buruk.
Kereaktifan kimia
Tidak dapat menggantikan hidrogen dari asid yang dicairkan. Bentuk kompleks ionik dengan asid organik dan bukan organik. Antimoni logam tidak bertindak balas dengan udara, tetapi ia dengan cepat diubah menjadi oksida ke udara basah.
Halogen dan sulfida dengan mudah mengoksidakan antimoni, jika proses berlaku pada suhu tinggi.
Aplikasi
Aloi
Antimoni digunakan dalam aloi dengan memimpin untuk menghuraikan plat untuk bateri kereta, meningkatkan rintangan plat, serta ciri -ciri beban.
Lead dan Alloy Tin telah digunakan untuk memperbaiki ciri -ciri kimpalan, serta peluru dan kartrij pengesan. Ia juga digunakan dalam aloi untuk salutan kabel elektrik.
Antimoni digunakan dalam aloi antifrik, dalam penyediaan aloi kulit dan pengerasan dengan kandungan timah rendah dalam pembuatan organ dan alat muzik lain.
Ia membentangkan ciri -ciri, dikongsi dengan air, peningkatan jumlah apabila dipeluwap; Oleh itu, antimoni hadir dalam aloi dengan plumbum dan timah, mengisi semua ruang acuan, meningkatkan definisi struktur yang dibuat dengan aloi ini.
Retardant api
Antimoni trioksida digunakan untuk penjelasan sebatian igniphed, selalu digabungkan dengan retardan api halogenasi, bromuros dan klorida.
Retarder kebakaran boleh bertindak balas dengan oksigen dan atom radikal oh, yang menghalang api. INCHISHED ini digunakan dalam pakaian untuk kanak -kanak, mainan, pesawat dan kerusi kereta.
Mereka juga ditambah dalam resin poliester, dan dalam komposisi serat kaca untuk barangan yang digunakan seperti penutup enjin pesawat ringan.
Sebatian antimoni yang digunakan sebagai retarder kebakaran termasuk: antimoni oxychloride, sbocl; antimoni pentoksida, SBO5; Antimoni Trichloride, SBCL3; dan antimoni trioksida, SBO3.
Bidang elektronik
Ia digunakan dalam pembuatan semikonduktor, diod, pengesan inframerah tengah, dan dalam penjelasan transitor. Antimoni kesucian tinggi, yang digunakan dalam teknologi semikonduktor, diperolehi dengan pengurangan sebatian antimoni dengan hidrogen.
Boleh melayani anda: faktor yang mempengaruhi kelarutanPerubatan dan Veterinar
Sebatian antimoni telah digunakan dalam bidang perubatan sejak zaman purba seperti eméticas dan antiprotozoa. Kalium kalium tartrato (tartar estetik) digunakan sebagai antisquisosomal untuk masa yang lama; juga digunakan sebagai expectorant, diaphoretic dan emético.
Garam antimon juga telah digunakan dalam pengkondisian kulit haiwan ruminan; seperti aniomalin, dan litium dan antimoni tiomalat.
Antimon Meglumine adalah ubat yang digunakan dalam rawatan leishmaniasis dalam lampu sorot luaran haiwan domestik. Walaupun, faedah terapeutik adalah terhad.
Pigmen dan lukisan
Sebatian antimoni digunakan dalam penjelasan cat dan pengabaian dalam enamel. Mereka juga digunakan dalam pigmen Bermellón, kuning dan oren, yang merupakan produk pengoksidaan perlahan sulfida antimoni.
Beberapa garam organiknya (tartratos) digunakan dalam industri tekstil untuk membantu dalam pautan pewarna tertentu.
Antimoni sulfida digunakan di Mesir kuno sebagai kosmetik dalam kegelapan mata.
Kegunaan lain
Beberapa garam antimoni digunakan sebagai ejen salutan untuk menghapuskan gelembung mikroskopik yang terbentuk di skrin televisyen. Ion antimoni berinteraksi dengan oksigen, menghapuskan kecenderungan mereka untuk membentuk gelembung.
Antimoni sulfida (III) digunakan di kepala beberapa perlawanan keselamatan. Antimoni sulfida juga digunakan dalam penstabilan pekali geseran bahan yang digunakan dalam pad brek kereta.
Isotop 124SB, bersama dengan berilium, digunakan sebagai sumber neutron, dengan purata tenaga 24 keV. Di samping itu, antimoni digunakan sebagai pemangkin dalam pengeluaran plastik.
Risiko
Ia adalah elemen rapuh, sehingga serbuk pencemar alam sekitar dapat terjadi semasa manipulasi. Di dalam pekerja yang terdedah kepada habuk antimoni, dermatitis, renitis, keradangan saluran pernafasan yang tinggi dan konjunktivitis telah diperhatikan.
Pneumoconiosis telah diterangkan, kadang -kadang digabungkan dengan perubahan paru -paru obstruktif, selepas pameran berpanjangan.
Antimoni trioksida boleh menyebabkan kerosakan pada fungsi jantung yang boleh menjadi manusia.
Pada orang yang terdedah kepada elemen ini, kehadiran jangkitan kulit pustular telah diperhatikan, sifat sementara.
Pengambilan dos rendah yang berterusan logam ini boleh menyebabkan muntah -muntah dan ulser perut cirit -birit. Juga, kepekatan maksimum yang boleh diterima di udara ialah 0.5 mg/m3.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Manny. (11 Mac 2009). Antimoni kuning dan antimoni letupan. Diperolehi daripada: AntimoniProperies.Blogspot.com
- Prof. Ernst Cohen dan J. C. Van den Bosch. (1914). Allotropi antimoni. Prosedur Royal Acad. Amsterdam. Vol. Xvii.
- Wikipedia. (2019). Antimoni. Diperoleh dari: dalam.Wikipedia.org
- Advameg, Inc. (2019). Antimoni. Pulih dari: kimiaExplaed.com
- Mc'oneal Saber. (15 September 2018). Kimia: Hartanah dan permohonan SB-Antimoni. Pulih dari: sederhana.com
- « Sejarah biogeografi, apa kajian dan contoh penyelidikan
- Punca Pencemaran Auditori, Akibat, Penyelesaian »

