Sejarah Arsenik, Struktur, Hartanah, Kegunaan

- 3899
- 666
- Anthony Breitenberg
Dia Arsenik Ia adalah semimetal atau metalloid yang dimiliki oleh kumpulan 15 atau pergi dari jadual berkala. Ia diwakili oleh simbol kimia sebagai, dan mempunyai nombor atom 33. Ia boleh berada di bawah tiga bentuk allotropik: kuning, hitam dan kelabu; Yang terakhir adalah satu -satunya dengan kepentingan perindustrian.
Arsenik kelabu adalah metalik, rapuh -lice pepejal, dengan warna yang steely dan kristal (imej yang lebih rendah). Kehilangan kecerahannya apabila terdedah kepada udara yang membentuk arsenioso oksida (sebagai2Sama ada3), yang apabila dipanaskan memancarkan bau bawang putih. Sebaliknya, alotrochos kuning dan hitam masing -masing adalah molekul dan amorf.
 Arsenik logam. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Arsenik logam. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Arsenik terletak di kerak bumi yang dikaitkan dengan banyak mineral. Hanya bahagian kecil yang berada di negeri asal, namun dikaitkan dengan antimoni dan perak.
Antara mineral yang paling biasa di mana arsenik adalah seperti berikut adalah: gejalgar (sebagai4S4), oropiment (sebagai2S3), Loellingita (jelek2) dan enargita (CU3Keldai4). Arsenik juga diperolehi sebagai produk cagaran dari penemuan logam seperti plumbum, tembaga, kobalt dan emas.
Sebatian arsenik beracun, terutama Arsina (Ash3). Walau bagaimanapun, Arsenik mempunyai banyak aplikasi perindustrian, termasuk aloi dengan plumbum, digunakan dalam penjelasan bateri kereta, dan aloi dengan gallium dengan beberapa kegunaan dalam elektronik.
[TOC]
Sejarah Penemuan Anda
Nama 'arsenik' berasal dari arsenicum Latin dan arsenikon Yunani, merujuk kepada hiasan kuning, yang membentuk bentuk utama penggunaan arsenik oleh alkimia.
Arsenik lama sebelum diiktiraf sebagai elemen kimia, diketahui dan digunakan dalam bentuk sebatiannya. Sebagai contoh, Aristotle pada abad keempat.C. Dia menulis mengenai sandarache, bahan yang kini difikirkan bahawa ia adalah sulfida arsenik.
Plinio El Viejo dan Pivanio Discorides, pada abad pertama.C., Mereka menggambarkan perhiasan, mineral yang dibentuk oleh2S3. Pada abad kesebelas, tiga spesies arsenik diiktiraf: putih (sebagai4Sama ada4), Kuning (sebagai2S3) dan merah (sebagai4S4).
Arsenik sebagai elemen murni, diperhatikan buat kali pertama oleh Albertus Magnus (1250). Magnus memanaskan sulfida arsenik dengan sabun, melihat penampilan bahan dengan ciri yang serupa dengan imej kelabu -gray imej. Walau bagaimanapun, laporan sahih pertama pengasingannya diterbitkan pada tahun 1649 oleh Johann Schroeder, seorang ahli farmasi Jerman.
Schroeder menyediakan arsenik dengan memanaskan oksida arang batu. Seterusnya, Nicolas Lémery berjaya memanaskannya dengan memanaskan campuran arsenik oksida, sabun dan potash. Pada abad ke -18, elemen ini akhirnya diiktiraf sebagai semimetal.
Ia boleh melayani anda: tiada elektrolit: ciri dan contohStruktur Arsenik
Arsenik adalah isomorfik kepada antimoni; Ini, secara struktural mereka sama, berbeza hanya dalam saiz atom mereka. Setiap atom arsenik membentuk tiga ikatan kovalen as-as, sedemikian rupa sehingga mereka berasal dari unit heksagon juga6 "Berkedut atau curam", kerana hibridisasi sebagai atom adalah SP3.
Kemudian unit6 Mereka menyambung menimbulkan lapisan arsenik yang curam, yang berinteraksi dengan lemah antara satu sama lain. Berikutan daya intermolecular mereka, terutamanya bergantung kepada massa atom mereka, kristal rhomnenic arsenik kelabu memberikan pepejal tekstur rapuh dan rapuh.
Mungkin disebabkan oleh penolakan elektron arsenik, unit6 Dibentuk di antara lapisan selari tidak menentukan octahedron yang sempurna tetapi diputarbelitkan:
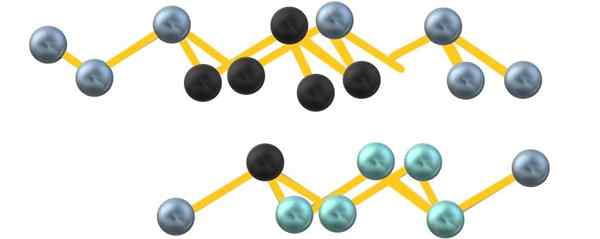 Struktur kristal arsenik kelabu. Sumber: Gabriel Bolívar.
Struktur kristal arsenik kelabu. Sumber: Gabriel Bolívar. Perhatikan bahawa sfera hitam melukis satah yang diputarbelitkan di ruang antara dua lapisan curam. Juga, di lapisan di bawah terdapat sfera kebiruan yang, di sebelah sfera hitam, membentuk unit6 disebutkan pada permulaan bahagian.
Struktur kelihatan diperintahkan, baris naik dan turun, dan oleh itu adalah kristal. Walau bagaimanapun, anda boleh menjadi amorf, dengan sfera yang diperah dengan cara yang berbeza. Apabila arsenik abu -abu menjadi amorf, ia menjadi semikonduktor.
Arsenik kuning
Arsenik kuning, alotropik yang paling toksik dari elemen ini, adalah pepejal molekul semata -mata. Terdiri daripada sebagai molekul4 unit dengan daya penyebaran yang lemah, yang tidak menghalang mereka daripada volatili.
Arsenik hitam
Arsenik hitam adalah amorf; Tetapi tidak bagaimana alotrope abu -abu. Strukturnya sedikit serupa dengan yang baru -baru ini6 Mereka mempunyai kawasan yang lebih besar dan corak gangguan yang berbeza.
Konfigurasi Elektronik
[AR] 3D104s24p3
Mempunyai semua orbital tahap 3 penuh. Pautan bentuk menggunakan orbital 4s dan 4p (serta 4d) oleh hibridisasi kimia yang berbeza.
Sifat
Berat molekul
74,922 g/mol
Penerangan fizikal
Arsenik kelabu adalah metalik kelabu -mintis pepejal, dan konsistensi rapuh.
Warna
Tiga bentuk allotropik, kuning (alpha), hitam (beta) dan kelabu (gamma).
Bau
Lavatory
Rasa
Tidak sedap
Takat lebur
1.090 K pada 35.8 ATM (Triple Arsenic Point).
Pada tekanan biasa tidak mempunyai titik gabungan, kerana ia menyahlai 887 k.
Ketumpatan
-Arsenik Kelabu: 5.73 g/cm3.
Ia boleh melayani anda: Kumpulan Carbonyl: Ciri -ciri, Harta, Tatanama, Kereaktifan-Arsenik kuning: 1.97 g/cm3.
Kelarutan air
Tidak larut
Radio atom
139 malam
Jumlah atom
13.1 cm3/mol
Radio Covalent
120 malam
Haba tertentu
0.328 j/g · mol pada 20 ºC
Haba penyejatan
32.4 kJ/mol
Elektronegativiti
2,18 pada skala Pauling
Tenaga pengionan
Tenaga pengionan pertama 946.2 kJ/mol
Keadaan pengoksidaan
-3, +3, +5
Kestabilan
Arsenik elemen stabil di udara kering, tetapi apabila ia terdedah kepada udara lembap, ia ditutup dengan lapisan gangsa kuning yang boleh menjadi lapisan hitam arsenik oksida (2Sama ada3).
Penguraian
Apabila arsenik dipanaskan untuk penguraian, ia memancarkan asap putih dari as2Sama ada3. Prosedurnya berbahaya kerana Arsina juga boleh dipancarkan, gas yang sangat beracun.
Arah diri
180 ºC
Kekerasan
3.5 Pada Skala Kekerasan Mohs.
Reaktiviti
Ia tidak diserang oleh asid sulfurik sejuk atau asid hidroklorik pekat. Bereaksi dengan asid nitrik atau asid sulfurik panas, membentuk asid arsenus dan asid arsenik.
Apabila arsenik kelabu volatilisasi oleh pemanasan, dan wap cepat disejukkan, arsenik kuning terbentuk. Ini kembali ke bentuk kelabu, apabila tertakluk kepada cahaya ultraviolet.
Aplikasi
Aloi
Sebilangan kecil arsenik ditambah untuk memimpin, menguatkan aloi cukup untuk menggunakannya dalam lapisan kabel, dan dalam penjelasan bateri kereta.
Penambahan arsenik ke tembaga, aloi tembaga dan zink, meningkatkan ketahanannya terhadap kakisan. Sebaliknya, ia membetulkan atau mengurangkan kehilangan zink di tembaga, yang menyebabkan peningkatan hayatnya yang berguna.
elektronik
Arsenik yang disucikan digunakan dalam teknologi semikonduktor di mana ia digunakan bersempena dengan Gallic.
GaA mempunyai selang band langsung, yang boleh digunakan dalam pembuatan diod, laser dan LED. Sebagai tambahan kepada Gallium Arseniuro terdapat arseniuros lain, seperti Arseniuro India dan aluminium arseniuro, yang juga membentuk semikonduktor II-V.
Sementara itu, kadmium arseniuro adalah semikonduktor jenis II-IV. Arsina telah digunakan dalam doping semikonduktor.
Pertanian dan pemuliharaan kayu
Kebanyakan aplikasi telah dibuang kerana ketoksikan yang hebat dan sebatian mereka. As2Sama ada3 telah digunakan sebagai racun perosak, sementara ace2Sama ada5 Ia adalah ramuan herbisida dan racun serangga.
Asid arsenik (h3ASO4) dan garam seperti kalsium dan arsenat plumbum, telah digunakan untuk mensterilkan tanah dan perosak kawalan. Ini menghasilkan risiko pencemaran alam sekitar dengan arsenik.
Boleh melayani anda: elemen cecair: apakah dan contohnyaLead Arseniato digunakan sebagai insektisida di pokok buah -buahan, sehingga separuh pertama abad kedua puluh. Tetapi kerana ketoksikannya, ia digantikan oleh natrium methylarsenate, yang berhenti digunakan untuk alasan yang sama sejak 2013.
Ubat
Sehingga abad kedua puluh beberapa sebatian mereka digunakan sebagai ubat. Sebagai contoh, Arsfenamina dan Neolsalvarsan digunakan dalam rawatan sifilis dan triposomiasis.
Pada tahun 2000, penggunaan AS telah diluluskan2Sama ada3, Sebatian yang sangat toksik, dalam rawatan promosi akut yang menjanjikan kepada asid asid retino-trans. Baru -baru ini, isotop radioaktif digunakan 74Adapun lokasi tumor.
Isotop menghasilkan imej yang baik, lebih jelas daripada yang diperoleh dengan 124Saya, kerana iodin dibawa ke tiroid dan menghasilkan bunyi dalam isyarat.
Kegunaan lain
Arsenik digunakan pada masa lalu sebagai makanan tambahan dalam pengeluaran ayam dan babi.
Ia digunakan sebagai pemangkin dalam pembuatan etilena oksida. Ia juga digunakan dalam piroteknik dan tan. Arsenioso Oxide digunakan sebagai decolorant dalam pembuatan kaca.
Di mana ia berada?
Arsenik boleh didapati dalam jumlah kecil dalam keadaan asas, dengan tahap kesucian yang tinggi. Ia terdapat dalam pelbagai sebatian, seperti: sulfida, arsenuros dan sulfarseniuros.
Ia juga terdapat dalam beberapa mineral, termasuk: arsenopyrite (FESAS), loellingita (hodoh2), enargita (CU3Keldai4), oropiment (sebagai2S3) Dan bersemangat (sebagai4S4).
Bagaimana ia diperoleh?
Arsenopirita dipanaskan hingga 650-700 ºC, tanpa adanya udara. Arsenik menguap, meninggalkan sulfida besi (FES) sebagai sisa. Semasa proses ini, arsenik mengikat oksigen untuk membentuk4Sama ada6, Dikenali sebagai "Arsenik Putih".
As4Sama ada6 Ia diubah suai untuk membentuk as2Sama ada3, wap yang dikumpulkan dan dipendekkan dalam satu set kamera bata, memurnikan arsenik dengan sublimasi.
Sebilangan besar arsenik dihasilkan dengan mengurangkan karbon debu yang terbentuk dari2Sama ada3.
Rujukan
- Stephen r. Marsden. (23 April 2019). Kimia Arsenik. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Helmestine, Anne Marie, Ph.D. (3 Disember 2018). Fakta menarik mengenai arsenik. Pulih dari: Thoughtco.com
- Wikipedia. (2019). Arsenik. Diperoleh dari: dalam.Wikipedia.org
- Dr. Dough Stewart. (2019). Fakta Elemen Arsenik. Chemicool. Pulih dari: chemicool.com
- Persatuan Kimia Diraja. (2019). Arsenik. Pulih dari: RSC.Atau
- Editor enyclopaedia Britannica. (3 Mei 2019). Arsenik. Encyclopædia Britannica. Pulih dari: Britannica.com
- « Ciri -ciri kumpulan minoriti, jenis, contoh
- Nombor reynolds untuk apa, bagaimana ia dikira, latihan »

