Ciri asparagin, struktur, fungsi, biosintesis
- 3966
- 72
- Julius Dibbert
The Asparagina (ASN atau N) adalah asid amino penting untuk isyarat sel dan kesatuan antara protein dan karbohidrat. Ini adalah salah satu daripada 22 asid amino asas dan diklasifikasikan sebagai tidak penting, kerana ia disintesis oleh badan mamalia.
Asid amino ini diklasifikasikan dalam kumpulan asid amino kutub tanpa beban dan merupakan asid amino yang pertama, fakta yang berlaku pada tahun 1806, di mana ia diasingkan dari jus asparagus (sejenis tumbuhan herba) oleh bahan kimia Perancis Vauquelin dan ROBIQUET.
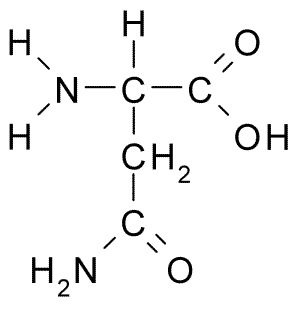
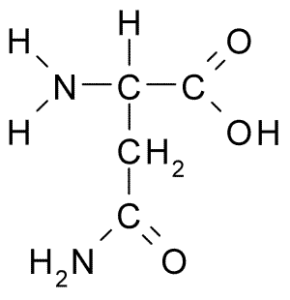 Struktur kimia asid amino asparagine (sumber: borb, melalui wikimedia commons)
Struktur kimia asid amino asparagine (sumber: borb, melalui wikimedia commons) Walaupun penemuan awalnya, peranan biologi dan pemakanan asparagine tidak diiktiraf tetapi lebih dari 100 tahun kemudian, pada tahun 1932, kehadirannya dalam struktur protein yang hadir dalam biji rami telah disahkan.
Asparagine dan glutamin berfungsi sebagai substrat untuk kumpulan dua asid amino yang sangat kerap dalam protein: aspartik (asid aspartik) dan glutamat (asid glutamat),. Asparagine dan glutamin mudah dihidrolisiskan dalam asid amino ini dengan tindakan enzimatik atau asid dan sebatian asas.
Banyak enzim serine protease yang bertanggungjawab untuk menghidrolisis ikatan peptida mempunyai asparagin di rantaian sampingan tapak aktif mereka. Sisa ini mempunyai beban separa negatif dan bertanggungjawab untuk bergabung dengan cara pelengkap dengan beban positif peptida putih, menghampiri tapak pemotongan.
Enzim yang bertanggungjawab terhadap sintesis oxalacetate dari asparagin digunakan dalam rawatan kemoterapi dan dikenali sebagai l-asparaginase, yang bertanggungjawab untuk memangkinkan pemecahan hidrolytik amida asparagine kepada aspartat dan ammonium.
Asparaginase terlalu jelas dan disucikan dari Escherichia coli, Untuk disuntik pada pesakit kanak -kanak yang mempunyai leukemia limfoblastik akut, kerana kedua -dua limfosit normal dan malignan bergantung kepada penangkapan asparagin dalam darah untuk pertumbuhan dan pendaraban.
[TOC]
Ciri -ciri dan struktur
Semua struktur kimia asid amino mempunyai kumpulan karboksil (-COH), kumpulan amino (-NH3+), hidrogen (-H) dan kumpulan r atau substituen yang disatukan oleh atom karbon pusat yang sama, yang dikenali sebagai karbon α.
Asid amino berbeza antara satu sama lain dengan identiti rantai sampingan mereka, yang mana yang dikenali sebagai kumpulan r dan yang boleh berbeza -beza dalam saiz, struktur, kumpulan berfungsi dan juga caj elektrik.
Atom karbon kumpulan r mengenal pasti dengan huruf dari abjad Yunani. Oleh itu, dalam hal asparagin karbon rantaian r dikenal pasti sebagai β dan γ karbon.
Boleh melayani anda: Agar XLD: Yayasan, Penyediaan dan KegunaanMenurut satu lagi jenis nomenclatures, atom karbon dalam kumpulan karboksil (-COH) disenaraikan sebagai C-1, jadi, berterusan dengan penomboran, karbon α akan menjadi C-2 dan sebagainya.
Molekul asparagin mempunyai empat atom karbon, termasuk karbon α, karbon karboksil karbon dan dua atom karbon yang merupakan sebahagian daripada kumpulan R, yang dikenali sebagai carboxamide (-CH2-co-co-NH2).
Kumpulan carboxamide ini hanya terdapat dalam dua asid amino: dalam asparagine dan glutamin. Ia mempunyai ciri-ciri yang dapat membentuk jambatan hidrogen dengan mudah melalui kumpulan amino (-NH2) dan kumpulan karbonil (-co).
Klasifikasi
Asparagine tergolong dalam kumpulan asid amino kutub tanpa beban, yang sangat larut asid amino di dalam air dan sangat hidrofilik (kerana kapasiti pembentukannya pelbagai jambatan hidrogen).
Dalam kumpulan asid amino kutub tanpa beban juga serine, treonine, sistein dan glutamin. Semua ini adalah sebatian "Zwitterionics", Oleh kerana mereka mempunyai kumpulan kutub dalam rantaian R yang menyumbang dengan peneutralan beban.
Semua asid amino kutub tanpa beban tidak boleh diionkan dalam pH hampir 7 (neutral) iaitu, mereka tidak mempunyai caj positif atau negatif. Walau bagaimanapun, dalam media berasid dan asas, substituen diionkan dan memperoleh beban.
Stereokimia
Karbon pusat atau karbon α asid amino adalah karbon kiral, maka, ia mempunyai empat substituen bersatu yang berbeza, yang menyebabkan sekurang -kurangnya dua stereoisomer yang boleh dibezakan untuk setiap asid amino.
Stereoisomer adalah imej spekular molekul yang mempunyai formula molekul yang sama, tetapi tidak boleh digunakan dengan satu sama lain, seperti tangan (kiri dan kanan). Mereka dilambangkan dengan huruf d atau l, kerana secara eksperimen penyelesaian asid amino ini memutarkan satah cahaya terpolarisasi ke arah yang bertentangan.
Asimetri umum asid amino menjadikan stereokimia sebatian ini sangat penting, kerana masing -masing mempunyai sifat yang berbeza, disintesis dan mengambil bahagian dalam laluan metabolik yang berbeza.
Asparagine boleh didapati dalam bentuk d-asparagine atau l-asparagine, yang terakhir adalah yang paling kerap. Ia disintesis oleh l-synthesase dan dimetabolisme untuk l-asparaginase, kedua-dua enzim sangat banyak di hati vertebrata.
Fungsi
Kemudahan membentuk jambatan hidrogen asparagin menjadikannya asid amino penting untuk kestabilan struktur protein, kerana ia dapat membentuk jambatan hidrogen dalaman dengan rantai sisi asid amino yang lain yang membuatnya naik.
Boleh melayani anda: 25 contoh pembiakan aseksualAsparagine biasanya dijumpai di permukaan media berair biasa, menstabilkan struktur mereka.
Banyak glikoprotein boleh mengikat karbohidrat atau karbohidrat melalui asparagine, treonine atau residu serine. Dalam kes asparagine, asetil galactosamine umumnya bergabung dengan kumpulan amino oleh N-glikisilasi.
Adalah penting untuk menyerlahkan bahawa dalam semua karbohidrat glikoprotein N-glikosilasi mengikat ini melalui residu asparagin yang berada di rantau tertentu yang dilambangkan sebagai asn-x-sers/thr, di mana x adalah asid amino.
Glikoprotein ini dipasang di retikulum endoplasma, di mana ia adalah glikosilasi kerana diterjemahkan.
Biosintesis
Semua organisma eukariotik mengasimilasikan ammonia dan mengubahnya menjadi glutamat, glutamin, karbamil-fosfat dan asparagine. Asparagine boleh disintesis dari perantara glikolitik, dalam kitaran asid sitrik (dari oxalacetate) atau dari prekursor yang digunakan dalam diet.
Enzim asparagine synthetase adalah amidotransferase yang bergantung kepada glutamin dan ATP yang ATP dan pirofosfat tak organik (PPI) meludah dan menggunakan ammonia atau glutamin untuk memangkinkan tindak balas amidasi dan menukar aspartat ke asparagine.
Kedua -dua bakteria dan haiwan mempunyai asparagine synthetase, bagaimanapun, dalam bakteria enzim menggunakan ion ammonium sebagai penderma nitrogen, sementara dalam mamalia synthetica synthesase menggunakan glutamin sebagai penderma utama kumpulan nitrogen.
Pecah enzimatik ATP ke amp dan pirofosfat tak organik (PPI), bersama-sama dengan glutamin sebagai penderma kumpulan amida, adalah perbezaan utama berkenaan dengan biosintesis L-glutamin antara organisma yang berbeza.
Degradasi
Kebanyakan kajian mengenai metabolisme asparagin telah dijalankan di dalam tumbuhan, memandangkan fakta bahawa pada mulanya kajian dalam mamalia dihalang oleh kekurangan metodologi yang cukup sensitif untuk ujian asid amino pada tahap sistem yang lebih kompleks.
L-asparagine sentiasa dihidrolisiskan dalam mamalia oleh l-asparaginase untuk menyebabkan asid aspartik dan ammonium. Ia digunakan untuk sintesis glikoprotein dan merupakan salah satu prekursor utama oxalacetate untuk kitaran asid sitrik.
Enzim asparaginase memangkinkan hidrolisis asparagin kepada aspartat, seterusnya aspartat ditransmisikan dengan α-cetoglutarate untuk menghasilkan glutamat dan oxalacetate.
Boleh melayani anda: EpiblastAsparagine syntheta, juga dikenali sebagai ligase aspartat-amoniaco, didapati banyak sel otak mamalia.
Apabila tahap enzim yang rendah ini dirasakan di dalam badan, apa yang dikenali sebagai "aminoacidopathies" dibentuk, kerana substrat prekursor berkumpul di sitoplasma sel otak.
Makanan yang kaya dengan asparagin
Orang yang mempunyai leukemia limfoblastik akut biasanya mempunyai kekurangan berkenaan dengan enzim asparagin synthetase dan bergantung kepada asparagine dalam edaran, jadi mereka disyorkan diet dalam makanan yang kaya dengan asparagine atau bekalan eksogen yang sama.
Antara makanan berganda dengan kandungan asparagin yang tinggi adalah dia.
Terdapat konsentrat l-asparagine yang dirumuskan untuk atlet persaingan yang tinggi, kerana penggunaannya membantu untuk menjana semula protein yang membentuk tisu.
Di samping itu, orang yang mengalami defisit dalam sintesis asid amino juga menelan tablet ini untuk mengelakkan gangguan dalam sistem saraf pusat mereka.
Asparagine lebih mudah untuk memetabolisme melalui bentuk l-asparagine, kerana banyak enzim yang terlibat dalam metabolisme mereka tidak mengiktiraf bentuk d-asparagine dan, oleh itu, tidak semua asparagine yang ditelan dalam makanan tersedia untuk proses organisma yang berbeza.
Pengambilan asparagin yang banyak mungkin bermanfaat, bagaimanapun, tidak disyorkan.
Rujukan
- Cooney, d. Ke., Capizzi, r. L., & Handschumacher, r. Dan. (1970). Penilaian metabolisme l-asparagine dalam anims dan lelaki. Penyelidikan Kanser, 30 (4), 929-935
- Dunlop, ms. C., Roon, r. J., & Bahkan, h. L. (1976). Penggunaan D-Asparagine oleh Saccharomyces cerevisiae. Jurnal Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Kemajuan dalam metabolisme asparagin. Dalam Kemajuan dalam Botani Vol. 79 (ms. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Perhimpunan oligosakarida berkaitan asparagin. Kajian Tahunan Biokimia, 54 (1), 631-664
- Mathews, c. K., & Ahern, k. G. (2002). Biokimia. Pendidikan Pearson.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip Biokimia Lehninger. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-asparagine. Akta Crystallographic Bahagian E: Laporan Struktur Dalam Talian, 63 (9), 3802-3803.

