Sejarah Borax, Struktur, Sifat, Kegunaan, Sintesis, Risiko

- 1450
- 327
- Delbert Dare
Dia Boraks atau natrium borat Ia adalah denominasi untuk sekumpulan sebatian kimia dengan formula asas NA2B4Sama ada7. Ia adalah garam hygroscopic yang mampu membentuk banyak hidrat, sebagai tambahan kepada struktur yang memperkaya diri mereka dengan kehadiran kekotoran logam tertentu.
Sebatian utama yang dipanggil Borax adalah seperti berikut: Anhydro Natrium Tetraborate, NA2B4Sama ada7; Natrium Pentahydrate Tetraborate (NA2B4Sama ada7).5h2Sama ada; dan natrium tetraborasi, na2B4Sama ada7.10h2Atau, atau setara, natrium octahydrate tetraborate, na2B4Sama ada5(Oh)4.8h2Sama ada.
 Serpihan boraks. Sumber: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Serpihan boraks. Sumber: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Seperti yang dapat dilihat, semua pepejal terdahulu hanya berbeza dalam tahap penghidratan mereka; Ada yang mempunyai lebih banyak molekul air dalam kristal mereka daripada yang lain. Borax secara fizikal serupa dengan kepingan atau kristal kapur yang mantap (imej unggul).
Sememangnya, borax ditemui di sedimen tasik bermusim, dikeringkan oleh penyejatan. Boraks berlaku di Turki, Searles Lakes (California), di Atacama, Chile, Bolivia, Tibet dan Romania Desert. Secara sintetik, kristal boraks boleh diperolehi melalui proses nukleasi yang perlahan; iaitu, satu di mana pertumbuhan kristal disukai.
Natrium, anhydrous dan decayrated tetraborate sedikit larut dalam air sejuk; Tetapi kelarutannya meningkat dengan peningkatan suhu. Na2B4Sama ada7.10h2Atau ia sangat larut dalam etilena glikol, larut sederhana dalam etanol dan larut sedikit dalam aseton; Ini kurang pelarut kutub daripada air.
Borax mempunyai banyak aplikasi, seperti dalam penjelasan detergen dan sabun; sebagai penangguhan api bahan selulosa; dalam pengeluaran gentian kaca; dalam pembersihan permukaan keras seperti logam, kaca dan seramik; dan dalam perencatan kakisan, antara kegunaan lain.
Borax menjengkelkan untuk mata, kulit dan saluran pernafasan. Dengan pengambilan ia dapat menghasilkan, antara gejala lain, muntah, cirit -birit, kendur, kerosakan dan sawan. Pada masa ini disyaki bahawa kesan berbahaya terhadap pembiakan manusia boleh.
[TOC]
Sejarah
Sejarah Borax membingungkan. Ia menunjukkan bahawa ia ditemui di atas katil tasik Tibet, dikeringkan oleh penyejatan. Ia dipindahkan pada abad ketujuh Tibet ke Arab Saudi, berikutan laluan sutera yang dipanggil.
Istilah "Borax" popular berikutan banyak aplikasi yang ditemui dan dipasarkan di bawah nama 20 keldai pasukan Borax Tradermax, yang merujuk kepada cara di mana Borax diangkut melalui padang pasir Nevada dan California.
Satu lagi versi penemuan mereka menunjukkan bahawa orang Mesir telah mengenali kewujudan mereka untuk masa yang lama, menggunakannya dalam kimpalan logam dengan panas. Di samping itu, mereka menggunakannya dalam bidang perubatan dan dalam proses mumia. Borax dipindahkan ke Eropah pada abad ketiga belas oleh Marco Polo.
Pada pertengahan abad ke -19, deposit boraks besar ditemui di Gurun Magove, yang membuat penggunaannya biasa sejak itu.
Struktur Borax
 Struktur ion boraks. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Struktur ion boraks. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Imej unggul menunjukkan ion -ion yang membentuk borax, khususnya sepadan dengan pepejal dengan formula komposisi na2[B4Sama ada5(Oh)4] · 8H2Atau (atau na2B4Sama ada7· 10h2Sama ada).
Pertama, struktur sangkar anion dapat diperhatikan [b4Sama ada5(Oh)4]2- (Walaupun saya harus mempunyai dua kumpulan-), di mana cincin oktagon (empat atom B dan empat O) dapat dilihat), dengan jambatan B-O-B membahagikannya kepada dua bahagian.
Boleh melayani anda: Penyelesaian alkali: definisi, sifat dan kegunaanSangkar ini tidak kekal statik, tetapi bergetar dan mengamalkan penyesuaian yang berbeza di ruang angkasa; Walau bagaimanapun, ke tahap yang lebih rendah di sekitar jambatan. Ia juga dapat diperhatikan bahawa ia sangat "oksigen"; Iaitu, ia mempunyai banyak atom oksigen, mampu berinteraksi dengan molekul air menggunakan jambatan hidrogen.
Tidak menghairankan maka kristal borax dapat menghidrat dan menghasilkan banyak hidrat. Oleh itu, untuk pepejal na2[B4Sama ada5(Oh)4] · 8H2Atau, terdapat lapan molekul h2Atau berinteraksi dengan sangkar borarate, dan pada masa yang sama, dengan pusat logam NA+.
Di sisi kation, anda mempunyai kompleks berair [na (h (h2Sama ada)4]+n, di mana nilai n bergantung kepada bahagian anion/kation. Di pepejal atas, n = 2, jadi anda mempunyai: [na2(H2Sama ada)8]2+, yang beban 2+ meneutralkan beban 2- anion borarate.
Kristal
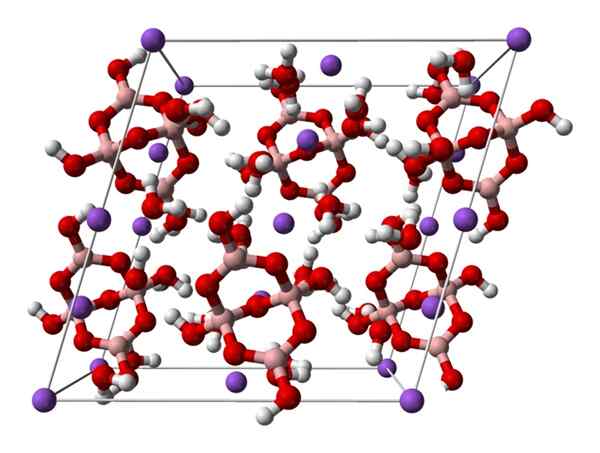 Sel Monoklinik Borax. Sumber: Ben Mills [Awam
Sel Monoklinik Borax. Sumber: Ben Mills [AwamDomain].
Naik2[B4Sama ada5(Oh)4] · 8H2Atau atau na2B4Sama ada7· 10h2Sama ada. Di sini tarikan elektrostatik dan jambatan hidrogen mengawal atau menguasai corak struktur yang berasal dari setiap gelas kaca.
Hydrates dan garam anhydrous lain kehilangan satu atau semua molekul air mereka, mengubah komposisi dan struktur kristal boraks. Dalam kesemuanya, anion dan kation tetap sama (kecuali ada kekotoran atau reaksi lateral), jadi kekeliruan tidak dapat dihasilkan.
Kebingungan dengan anion boraato
Na2[B4Sama ada5(Oh)4] · 8H2Atau dan na2B4Sama ada7· 10h2Atau mereka sama. Kerana?
Pertama, jika atom mereka dikira, mereka akan melihat bahawa mereka bertepatan dengan jumlah; Dan kedua, dalam anion b4Sama ada72- Ketiadaan dua kumpulan OH yang dikaitkan dengan kepala boron jambatan B-O-B dianggap; dua oh itu, bersama -sama dengan dua h+ dari b4Sama ada72-, tambah sehingga 2 jam2Atau, memberikan 10 jam2O (8 + 2).
Sifat
Nama
- Borax.
- Natrium borarate.
- Natrium tetraborasi.
- Datorable tetraborate.
Jisim molekul
Anhydro: 201,22 g/mol.
Decohydrate: 381.38 g/mol.
Penampilan fizikal
Pepejal putih kristal.
Ketumpatan
Anhydrous: 2.4 g/cm3
Decaha campuran: 1,739 g/cm3
Takat lebur
Anhidro: 743 ºC (1.369 ºF, 1.016 k).
Decohydrate: 75 ºC.
Takat didih
Anhidro: 1.575 ºC (2.867 ºF, 1.848 k).
Kelarutan air
31.78 g/l (kedua -duanya untuk anhydrous dan decayroper).
Kelarutan dalam pelarut organik
Ia sangat larut dalam etilena glikol, sederhana larut dalam diethylene glycol dan metanol, dan sedikit larut dalam aseton.
Indeks Pembiasan (ηd)
Anhidro: η1 = 1,447; η2 = 1,469.
Repatrado: η2 = 1,472.
Kestabilan
Ia stabil di bawah keadaan penyimpanan yang mencukupi. Walaupun ia mempunyai tekanan stim yang rendah, ia meningkat dengan suhu, menyebabkan penghabluran dan pemeluwapan, sehingga suhu yang berlebihan dan turun naik kelembapan harus dielakkan.
Pelepasan cahaya
Natrium menetraborasi apabila tertakluk kepada tindakan api memancarkan lampu hijau.
Reaksi
- Apabila larut di dalam air, penyelesaian alkali berasal dengan pH sekitar 9.2.
- Borax bertindak balas untuk membentuk borat lain, seperti Perborate (PBS).
- Ia juga menghasilkan asid borik apabila bertindak balas dengan asid hidroklorik:
Na2B4Sama ada7· 10h2O + hcl => 4 jam3Bo3 + 2 na+ + 2 Cl- + 5 jam2Sama ada
- Natrium tetraborasi bertindak sebagai bahan amphohete, kerana dalam larutan akueus ia dihidrolisis dan dapat meneutralkan asid. Dengan cara yang sama, ia dapat meneutralkan alkali kepekatan tinggi, mengelakkan ketinggian pH sederhana yang berlebihan.
Boleh melayani anda: Alkohol utama: struktur, sifat, nomenclature, contohAplikasi
Borax mempunyai banyak aplikasi, baik dalam manusia dan dalam set aktiviti yang dilakukannya.
Tindakan antioksidan
Borax mempunyai keupayaan untuk membubarkan oksida. Atas sebab ini ia digunakan dalam pemulihan logam seperti tembaga, tembaga, plumbum dan zink.
Ia juga digunakan untuk mengelakkan pengoksidaan bar logam di asas. Borax merangkumi permukaannya, tidak termasuk udara, dan oleh itu, mengelakkan pengoksidaan. Di samping itu, ia menghalang kakisan bahan ferus dalam pembuatan kereta.
Kelarutan Borax dalam etilena glikol telah berguna dalam formulasi antibeku. Borax meneutralkan sisa berasid yang dihasilkan semasa penguraian etilena glikol, meminimumkan pengoksidaan bahawa permukaan logam dapat menderita.
Penghuraian pelekat
- Borax adalah sebahagian daripada formulasi kanji pelekat untuk kertas dan kadbod bergelombang.
- Ia adalah ejen peptizing dalam pembuatan pelekat berdasarkan kasein dan dextrin.
- Bertindak menguatkan bahan pelekat dengan menyeberangi kumpulan hidroksil yang konjugasi.
Retardant api
Ia digunakan sebagai retardan api dalam bahan selulosa dan polimer lain yang mengandungi kumpulan hidroksilia. Ia melakukan tindakannya melalui beberapa mekanisme, termasuk pembentukan lapisan vitreous yang menghadkan akses bahan api.
Penghuraian Kaca Borosilized (Pyrex)
Borax adalah sumber boron yang digunakan dalam penjelasan kaca borosilisasi; dicirikan oleh titik gabungan yang tinggi, pekali pengembangan yang rendah dan rintangan tinggi terhadap kejutan terma.
Ini membolehkan anda tertakluk kepada suhu tinggi tanpa mengalami patah tulang, menerima denominasi kaca refraktori.
Kaca borosilisasi digunakan dalam penjelasan bahan yang akan digunakan di rumah untuk membakar makanan. Ia juga digunakan dalam makmal di bikar, fixolas, langkah -langkah silinder, pipet, dll.
Pengemulsi
Borax, bersama -sama dengan sebatian lain, digunakan untuk mengemulsikan sabun dan parafin lain. Ia juga digunakan sebagai asas untuk menghuraikan losyen, krim dan salap.
Bahan pembersihan
- Ia ditambah dalam formulasi untuk membersihkan permukaan tegas seperti logam, kaca dan seramik.
- Ia digunakan dalam pembersih tangan, bahan penggilap dan sabun detergen penggunaan dalam laundri dan rumah. Di samping itu, ia memudahkan penyingkiran deposit berminyak dari lantai kilang.
Penggunaan Perubatan
- Ia digunakan dalam rawatan jangkitan kulat kaki.
- Ia adalah sebahagian daripada formula nutrien yang membekalkan boron. Unsur ini dianggap campur tangan dalam metabolisme kalsium, fosforus dan magnesium, yang diperlukan untuk struktur tulang.
- Ia campur tangan dalam penentuan hemoglobin glikosilat (HBA1c), bukti yang berfungsi untuk mengetahui perkembangan diabetes panjang dalam pesakit, kerana separuh masa erythrocyte adalah 120 hari.
Maklumat ini lebih berguna untuk doktor daripada penentuan terpencil glukosa darah pesakit.
Penyerap kejutan pH
Ia digunakan dalam beberapa penyerap kejutan pH yang digunakan dalam biokimia; Antaranya, tris (hydroxymethyl) aminomethane-boray, yang digunakan dalam elektroforesis dalam polyacrylamide DNA dan asid nukleik RNA.
Penurunan kekerasan air
Borax dapat bergabung dengan ion kalsium dan magnesium yang terdapat di dalam air, mengurangkan kepekatannya. Dengan cara ini kekerasan air dikurangkan.
Boleh melayani anda: kalium hidroksida: struktur, sifat, kegunaanBaja dan baja
Borax digunakan sebagai sumber boron. Kalsium dan boron terlibat dalam pembentukan dinding sel tumbuhan. Di samping itu, telah menunjukkan bahawa boron nikmat pendebungaan, jadi ia campur tangan dalam persenyawaan dan percambahan tumbuhan.
Pemuliharaan kayu
Borax melawan kayu kayu, kumbang yang menggunakan dan memusnahkan kayu. Ia juga digunakan dalam pemuliharaan dan penyelenggaraan kapal kayu.
Penubuhan dan aliran
Ia digunakan sebagai pengasas dalam kimpalan keluli dan besi, menyebabkan penurunan titik lebur dan penghapusan oksida besi; Pencemar yang tidak diingini. Dengan hujung yang sama, ia mengambil bahagian dalam kimpalan emas dan perak.
Yang lain
- Ia digunakan sebagai racun perosak yang lembut; Contohnya, untuk pertempuran rama -rama dalam bulu.
- Disembur berfungsi untuk mengawal perosak yang terdapat di kabinet, deposit dalaman, di dalam jurang dinding, dan secara umum, di mana penggunaan lebih banyak pencemaran racun perosak tidak dikehendaki.
- Ia digunakan dalam reaktor nuklear untuk mengawal tindak balas yang dapat dihasilkan, dalam kes -kes yang melampau, tindak balas rantai.
- Di Radiator Kereta, Borax digunakan untuk mendapatkan tapak di mana terdapat air melarikan diri.
Sintesis
Borax diperolehi oleh React5Sama ada9.8h2Atau, dengan natrium karbonat dan natrium hidrokarbonat dalam medium berair.
Sebenarnya, sintesis natrium atau borax tetraborasi digunakan sedikit; Sebilangan besar kompaun yang dihasilkan diperolehi oleh pengekstrakan mineral yang mengandunginya.
Proses ini dapat diringkaskan dalam larutan bijih di dalam air, diikuti dengan penapisan tanah liat dan akhirnya penyejatan larutan akueus.
Risiko
Borax adalah produk semulajadi, bagaimanapun, ia dapat menghasilkan satu siri kerosakan kesihatan pada manusia. Sebagai contoh, kerana bersentuhan dengan habuk debu, kerengsaan kulit yang boleh menyebabkan dermatitis dapat berlaku.
Begitu juga, borax menghasilkan kerengsaan mata dan saluran pernafasan atas. Antara gejala penyedutannya, ada batuk dan sakit tekak.
Sementara itu, pengambilan borax membentangkan gejala berikut: muntah, loya, cirit -birit, kendur, sakit kepala dan sawan. Di samping itu, pengaruh sistem saraf pusat dan fungsi buah pinggang boleh berlaku.
Dari kajian yang dijalankan di tikus lelaki -sex, diberi makan dengan boraks, atrofi testis diperhatikan. Walaupun kajian yang dijalankan dengan tikus wanita hamil menunjukkan bahawa borax dapat menyeberangi plasenta, menghasilkan perubahan perkembangan janin, yang ditunjukkan oleh berat lahir rendah.
Dipercayai bahawa pendedahan borax dapat mempengaruhi fungsi pembiakan lelaki pada manusia, yang ditunjukkan oleh pengurangan pengiraan sperma.
Dos maut 10 hingga 25 gram dianggarkan untuk pengambilan boraks pada orang dewasa.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Argon. Pangkalan data PUBCHEM. CID = 23968. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Karolyn Burns, Seneca Joseph, & Dr. Ryan Baumbach. (s.F.). Sintesis dan sifat kristal boraks dan aloi intermetalllic. Pulih dari: Nationalmaglab.org
- Wikipedia. (2019). Borax. Diperoleh dari: dalam.Wikipedia.org
- Rio Tinto. (2019). Borax dehydrate. 20 Mule Team Borax. Pulih dari: borax.com
- Fletcher Jenna. (14 Januari 2019). Adakah borax selamat digunakan? Pulih dari: MedicalNewStody.com
- « Struktur, CRCL3) Struktur, Hartanah, Kegunaan Chrome Chrome
- Ciri -ciri Makanan Transgenik, Kelebihan, Contoh, Akibat »

